来年度の材料制度改革に向けて厚生労働省は9月11日、中医協・保険医療材料専門部会(関ふ佐子部会長=横浜国立大大学院教授)を開き、「今後の主な検討事項」を挙げた上で「イノベーションの評価」に関する4項目について論点を示した。その中で、「ニーズ選定されたにもかかわらず開発に至らない品目への対応」については、改善の傾向にあることや他の支援制度との関係などを指摘した上で「今後の実態を踏まえ、必要に応じて検討してはどうか」とした。これに保険者を代表する委員から「企業には社会的責任がある。利益が出ないからと放置している所には何らかのディスインセンティブを個別に検討してもいい」との意見もあった。【新井裕充】
.
- 説明 ── 今後の主な検討事項
- 説明 ── ① ニーズ選定されたにもかかわらず開発に至らない品目への対応
- 説明 ── ② 迅速な保険導入に係る評価
- 説明 ── ③ 機能区分の特例
- 説明 ── ④ 先駆け審査指定制度に指定された製品の評価
- 質疑 ── 日本医師会(意見と質問)
- 質疑 ── 日本歯科医師会(質問)
- 質疑 ── 健康保険組合連合会(意見と質問)
- 質疑 ── 厚労省医療機器審査管理課・中井課長(回答)
- 質疑 ── 健康保険組合連合会(意見)
.
厚労省が同日の部会で示した「今後の主な検討事項」は、イノベーションの評価、内外価格差の是正などで、このうちイノベーションの評価を中心に4項目について「論点」を整理し、委員の意見を聴いた。
厚労省が今回のテーマに挙げたのは、①ニーズ選定されたにもかかわらず開発に至らない品目への対応、②迅速な保険導入に係る評価、③機能区分の特例、④先駆け審査指定制度に指定された製品の評価──の4項目。
.
このうち①について厚労省は「今後の実態を踏まえ、必要に応じて検討」とした。試行的に継続している②については、「現行の運用を継続」「今後も引き続き検討」とし、③についても「現行の運用を継続」とした。④については、業界から要望のあった「先駆け審査指定制度加算」の新設について、「その他の取組との位置づけの整理についてどう考えるか」とした。
厚労省担当者の説明と質疑の模様は、以下のとおり。
Contents
説明 ── 今後の主な検討事項
〇関ふ佐子部会長(横浜国立大学大学院国際社会科学研究院教授)
よろしいでしょうか。ただいまより、第102回中央社会保険医療協議会「保険医療材料専門部会」を開催いたします。
まず本日の委員の出欠状況について報告します。本日は、染谷(絹代)委員(静岡県島田市長)がご欠席です。なお、会議冒頭のカメラの頭撮りはここまでとさせていただきます。
それでは、議事に入らせていただきます。今回は、「保険医療材料制度の見直しの検討について」を議題といたします。事務局より資料が提出されておりますので、説明をお願いします。
〇厚労省保険局医療課医療技術評価推進室・岡田就将室長
医療技術評価推進室長でございます。それでは、資料「材ー1」をご覧ください。保険医療材料制度の見直しに向けまして、保険医療材料等専門組織および関係業界からのご意見を踏まえた、これまでのご意見、議論を踏まえまして、今回より具体的な検討を行なっていただきたいと考えております。
資料の2ページ目をご覧ください。「今後の主な検討事項」でございます。
.
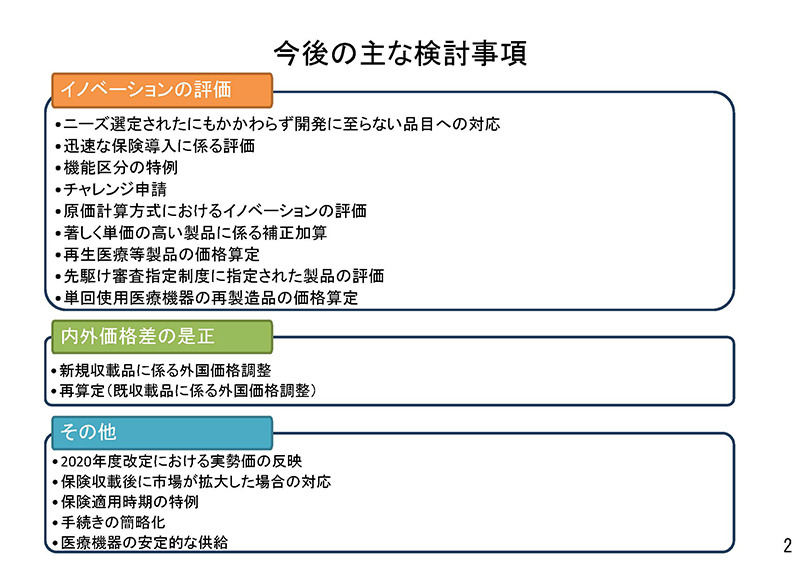
平成30年度改定における改定の骨子において、今後検討することとされた事項、また、これまでに中医協で問題提起をいただきました事項、また保材専(保険医療材料等専門組織)から提起された事項、関係業界から提起された事項をもとに、検討事項を挙げさせていただきました。
これらの事項につきまして、計4回程度で、今後、ご議論をいただきたいと考えております。
本日は、イノベーションの評価のうち、
・ ニーズ選定されたにもかかわらず開発に至らない品目への対応
・ 迅速な保険導入に係る評価
・ 機能区分の特例
・ 先駆け審査指定制度に指定された製品の評価
の4点についてご検討いただきたいと考えております。
説明 ── ① ニーズ選定されたにもかかわらず開発に至らない品目への対応
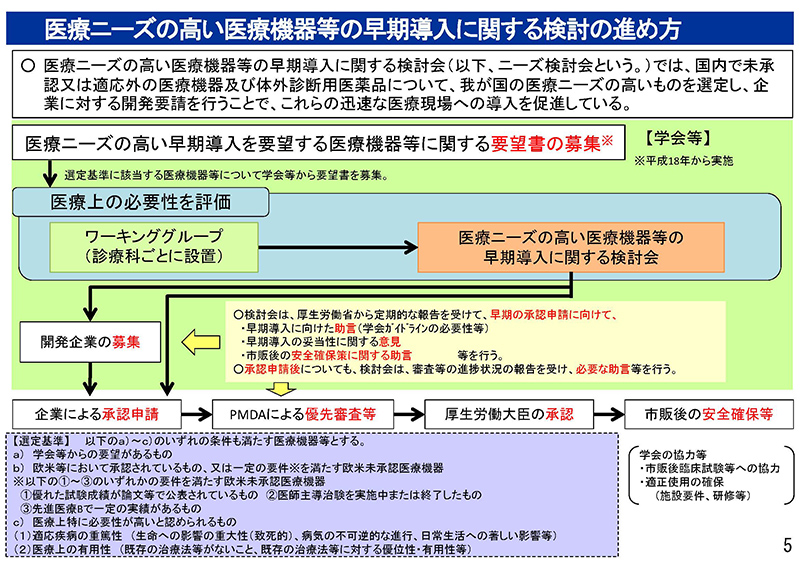
5ページ目、6ページ目でございます。こちらは「医療ニーズの高い医療機器等の早期導入に関する検討会」、「ニーズ検討会」と申しますけれども、
.
.
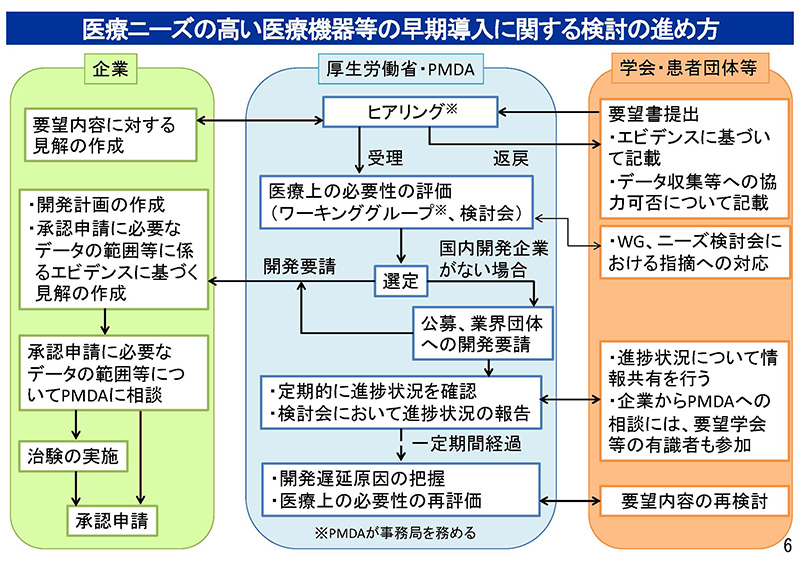
これにおきまして国内で未承認、または適応外の医療機器および体外診断用医薬品について、わが国の医療ニーズの高いものを選定し、企業に対する開発要請を行うことで、これらの迅速な医療現場への導入を促進するという枠組みについて説明をさせていただいた資料でございます。
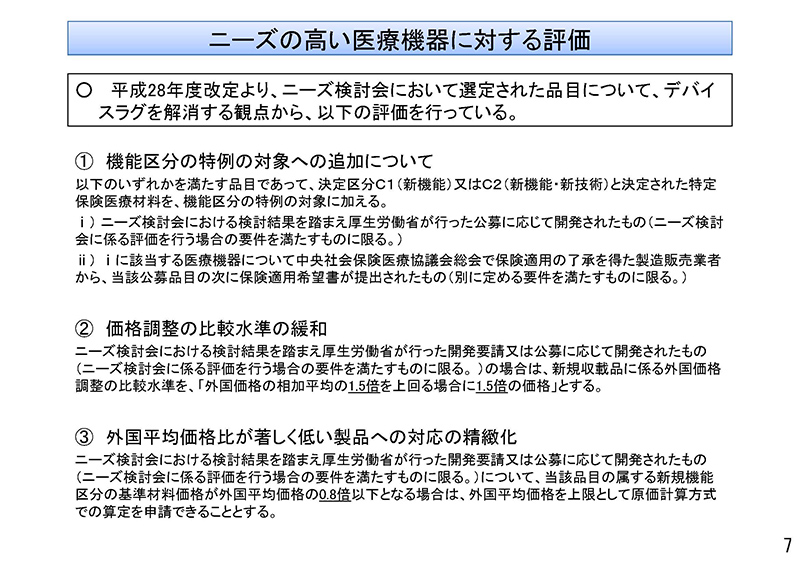
こうしたニーズの高い医療機器に対する保険導入時の評価といたしまして、平成28年度改定より「ニーズ検討会」において選定された品目について、デバイスラグを解消する観点から、①、②、③の評価を行っているところでございます。
その1つ目は、機能区分の特例の対象への追加
2つ目は、価格調整の比較水準の緩和
3番目は、外国平均価格比が著しく低い製品への対応の精緻化
といった評価を行っているところでございます。
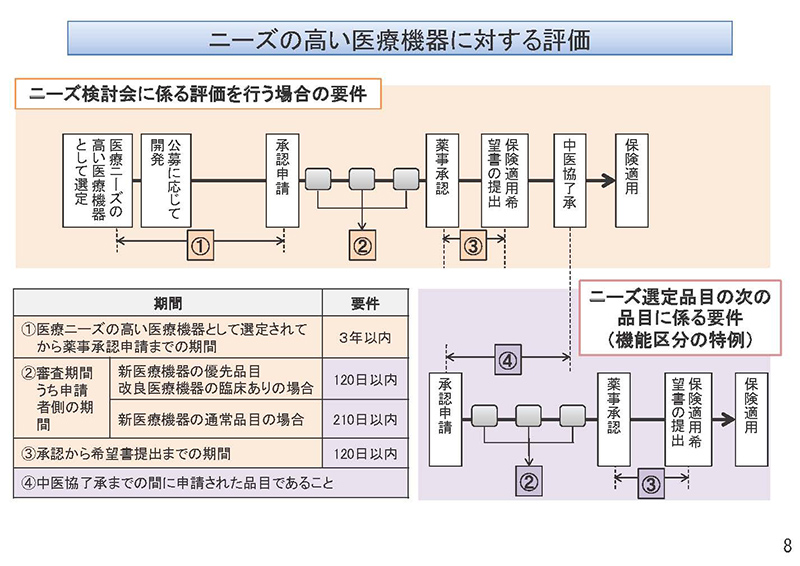
こうしたは評価の対象となるための要件でございますけれども、具体的には「ニーズ検討会」において選定をされましてから、薬事承認申請をするまでの期間、ここでいう①の期間、
また、審査期間中のうち申請者側の期間、②の期間、
さらに承認から希望書提出までの期間、③の期間、
それぞれ日数の要件をかけておりまして、こうした要件を満たしている品目に対する評価というふうになっております。
こうした評価の枠組みがございますけれども、「ニーズ検討会」から開発要請を行ってニーズ選定をし、開発要請を行っているにもかかわらず、一定期間以上、開発が進まない製品といったものも存在しております。
平成30年度改定におきましては、開発に至らない理由といたしまして、個別事情によるところが大きく、10ページ目に掲げておりますオーファンの指定制度、
.
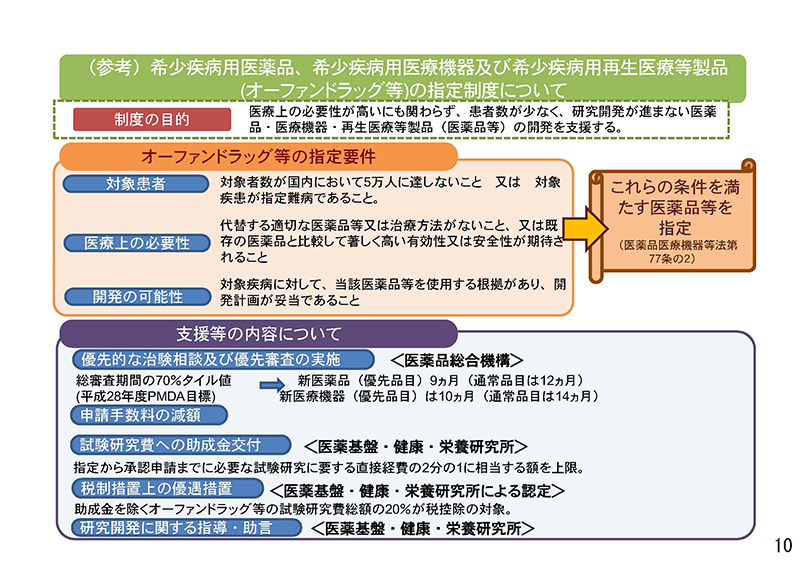
また11ページ目に掲げております「革新的医療機器条件付早期承認制度」、
.
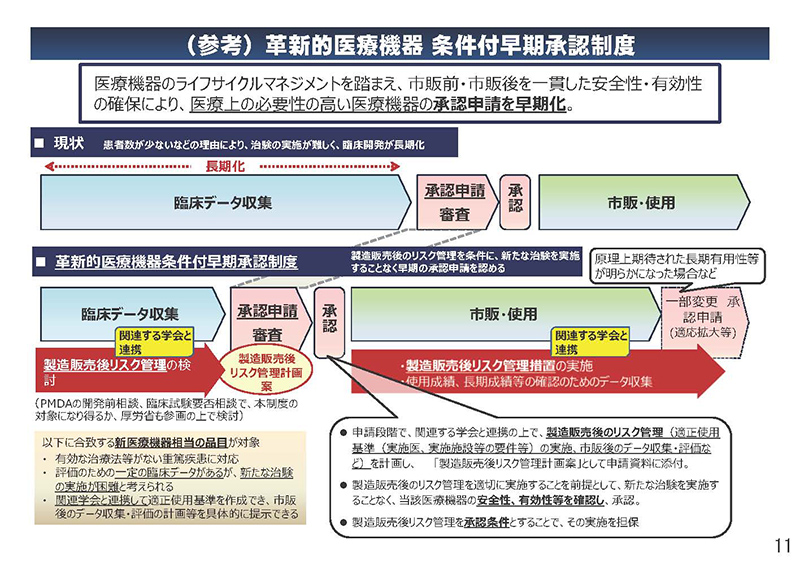
各種の制度の充実により対応が進められていることを踏まえ、30年度改定におきましては、こうした支援制度の活用を推進するということで、今後も、開発ニーズ選定品の開発状況を注視をしながら、開発が進められない企業が申請をする新規医療材料の取扱いについて検討を行っていくこととなったところでございます。
13ページ目は、医療ニーズの高い医療機器の実績につきまして、「ニーズ検討会」において選定された品目のうち、平成30年度改定以降に保険適用されました新規医療材料について紹介をしたものでございます。こちらは6製品と、以前と比べると増えてきているというものでございます。
14ページ目をご覧ください。こちらは、本年3月時点での開発状況。
.
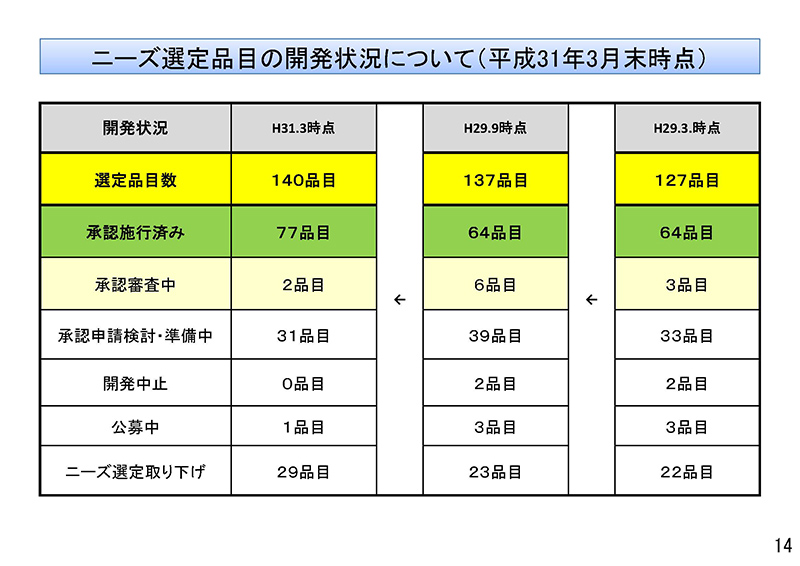
これは過去、右側から追ってご覧いただければと思いますけれども、平成29年3月時点では「選定品目数」、127品目であったものが、29年9月には137品目に増え、31年3月には140品目に増えているところ。
「承認施行済み」は2段目でございますけれども、平成29年3月、64(品目)だったものが、平成31年の3月には77品目に増えております。4段目、「承認申請検討・準備中」というものにつきましては、平成29年3月が33品目、29年9月には39品目に増えておりますが、31年3月には31品目と減少しております。
15コマ目をご覧ください。こちらは、「承認申請検討・準備中」、また「公募中」とされております、計32品目の現状を見たものでございます。17品目がですね、ニーズ選定から5年以上経過している品目でございまして、それぞれの状況につきましては以下の資料のとおりとなっております。
.
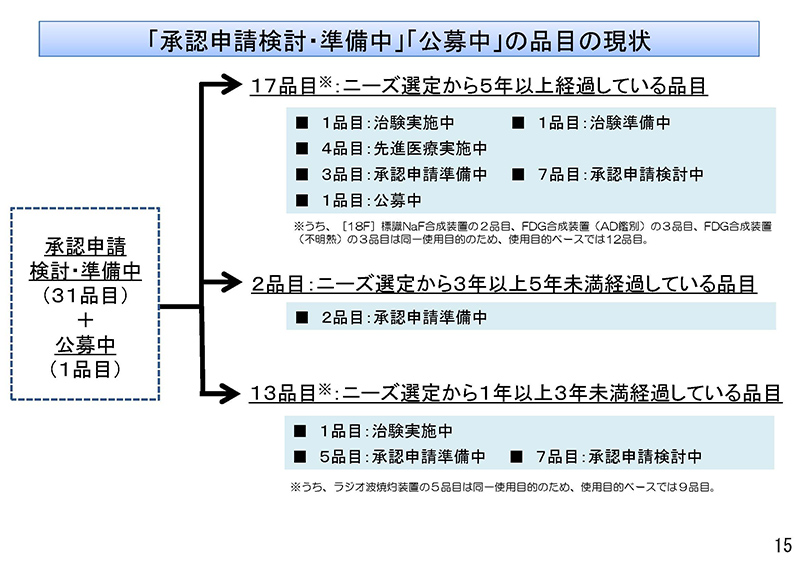
また、32品目のうち2品目がニーズ選定から3年以上5年未満経過している品目となっておりまして、13品目がニーズ選定から1年以上3年未満経過している品目ということとなっております。
16ページ目は、30年度改定で「さまざまな支援制度の活用状況を見ながら」とされたところでございますけれども、現状における、こうした制度の利活用状況についてご紹介をしたものでございます。
.

これまで、「希少疾病用医療機器の指定制度」を利用しているものが2品目ございます。また、「革新的医療機器条件付早期承認制度」の利用を検討している品目が2品目という状況でございます。
こうした状況を受けまして、事務局としてですね、「論点」として掲げさせていただきましたのが17ページということでございます。
.

「ニーズ検討会」から開発要請を受けているにもかかわらず、一定期間以上、開発が進まない製品が存在しておりますが、平成30年度以降、保険適用の実績は増えてきております。
開発状況を見ても、「薬事承認施行済」の品目が増えつつございまして、「承認申請検討・準備中」の品目が減少傾向となっております。
「革新的医療機器条件付早期承認制度」の利用を検討されている品目もございまして、今後も各種制度の効率的な活用により、開発が促進される可能性があるのではないかという認識のもと、「論点」の所で記載をしておりますが、
近年、ニーズ選定品目の保険適用の実績が増えていることや、今後、各種制度の活用による開発の促進が見込まれることから、引き続き、こうした制度の活用を推進することとし、開発を進めない企業が申請をする新規医療材料の取扱いについては、今後の実態を踏まえ、必要に応じ検討してはどうか、とさせていただいております。
説明 ── ② 迅速な保険導入に係る評価
続きまして、「迅速な保険導入に係る評価」でございます。
19ページ目をご覧ください。平成24年度改定におきまして、デバイスラグの解消を目的に「迅速な保険導入に係る評価」の枠組みが試行的に設けられたところでございます。
.
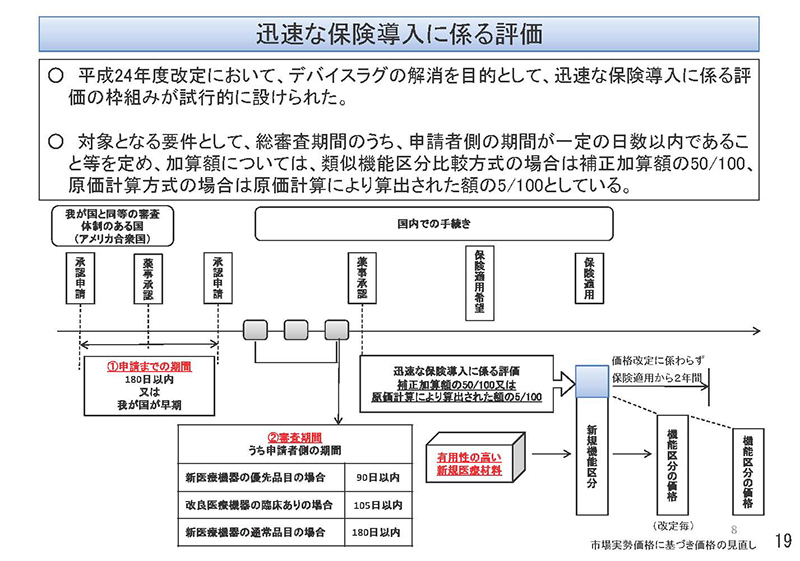
対象となる要件といたしまして、総審査期間のうち、申請者側の期間が一定の日数以内であることなどを定めまして、加算額につきましては類似機能区分比較方式の場合は補正加算額の100分の50、原価計算方式の場合は、原価計算により算出された額の100分の5としており、こうした加算の適用から、2年に限り、加算をすることとしております。
20ページ目をご覧ください。「迅速な保険導入に係る評価」につきましては、改定ごとに、その継続と要件の見直しが検討されてきております。
.
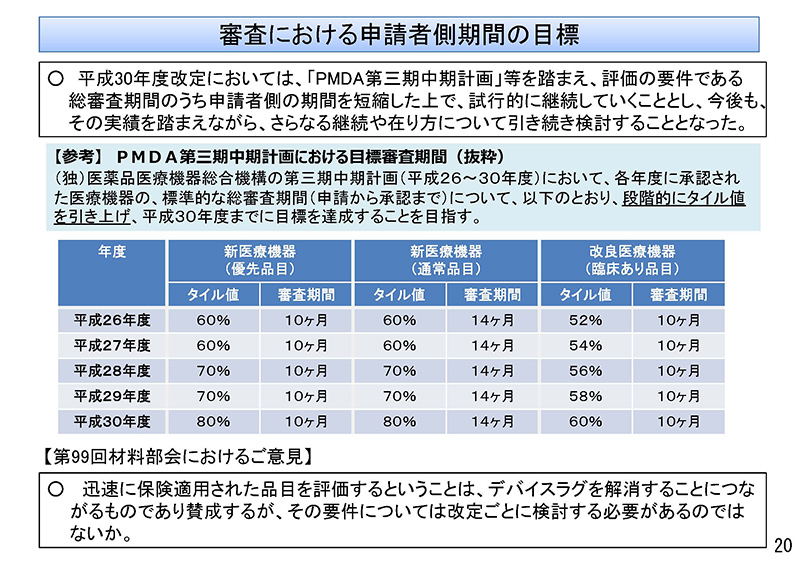
平成30年度改定では、「PMDA第3期中期計画」などを踏まえ、評価の要件であります総審査期間のうち「申請者側の期間」、これを短縮、見直しした上で試行を継続していることとされております。
さらに、今後もその実績を踏まえながら、さらなる継続や在り方について引き続き検討するとされたところでございます。
21ページ目をご覧ください。
.
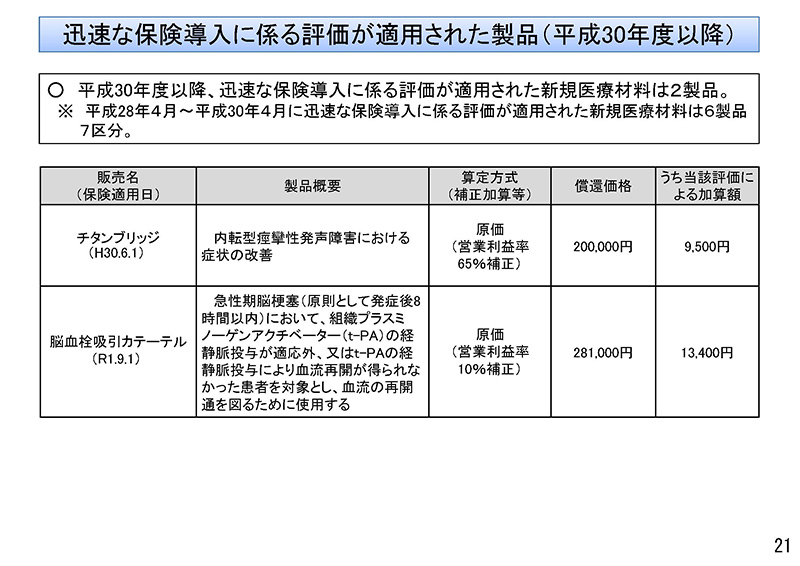
平成30年度以降、「迅速な保険導入に係る評価」が適用されました新規医療材料は2製品となっております。
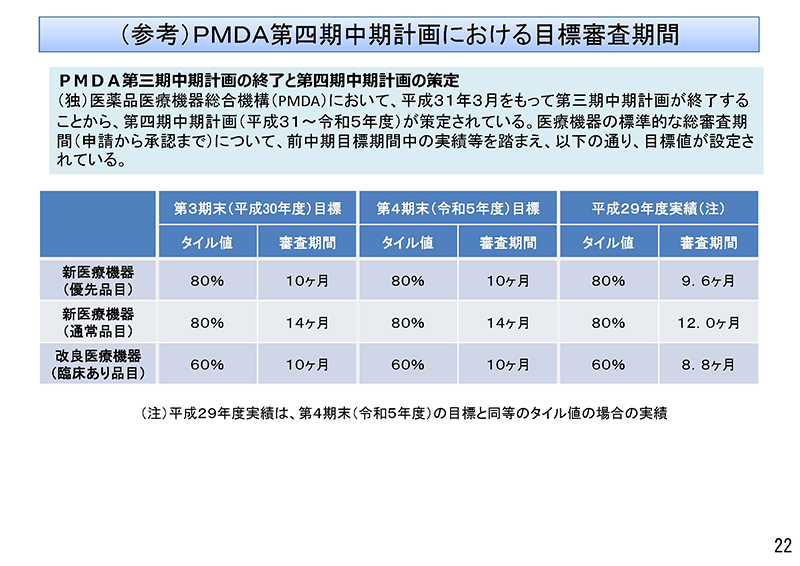
PMDAにおきましては、平成31年3月をもって「第3期中期計画」が終了し、「第4期中期計画」が現在実施されているところでございます。その中で、医療機器の標準的な総審査期間、申請から承認まででございますけども、(総審査期間)につきましては、 第3期末と同様の目標値が設定をされているところでございます。
23ページをご覧ください。平成30年度以降に「迅速な保険導入に係る評価」が適用された製品は2製品でございます。
.

一方、新たに策定をされました「PMDA第4期中期計画」においては、標準的な総審査期間について、第3期末と同様の目標値が設定をされているところでございます。
保険導入の迅速性を評価するものであり、臨床的有用性を評価している機能区分の特例や、補正加算とは異なる位置づけのものであり、デバイスラグの解消に一定の効果があるというふうに考えております。
こうしたことから、「論点」に記載をしておりますように、試行的に継続している「迅速な保険導入に係る評価」につきましては 、「PMDA第4期(中期)計画」の目標値や、デバイスラグの解消に対する効果を踏まえ、現行の運用を継続することとしてはどうか。
また、わが国におけるデバイスラグの実態や今後の見通しを踏まえ、「迅速な保険導入に係る評価」の継続について、今後も引き続き検討することとしてはどうか、とさせていただいております。
説明 ── ③ 機能区分の特例
続きまして、「機能区分の特例」でございます。25ページ目をご覧ください。
.
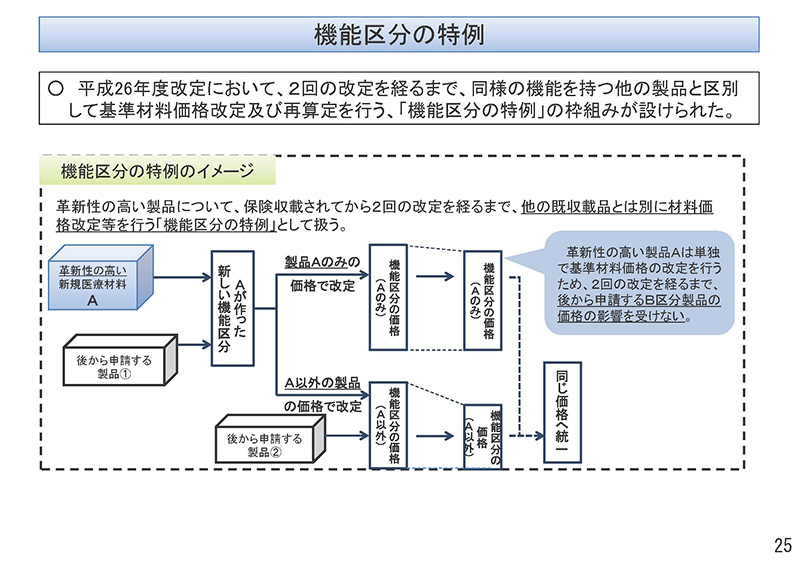
平成26年度改定におきまして、2回の改定を経るまで、同様の機能を持つ他の製品と区別して、基準材料価格改定および再算定を行います「機能区分の特例」の枠組みが設けられております。
.

26ページ目でございますけれども、「機能区分の特例」につきましては、改定ごとに、その継続と対象の見直しが検討されておりまして、平成28年度の改定におきましては、26ページ目の上から3つ目の黒丸でございますけれども、
「ニーズ検討会」による検討結果を踏まえ、厚労省が行った公募に応じて開発されたものが対象に加えられ、平成30年度改定において4つ目の「先駆け審査指定制度」の対象品目として指定され、承認された医療材料を対象に加えつつ、継続的に運用をしていくこととし、今後もさらなる継続や、対象の追加および削除を引き続き検討することとされたところでございます。
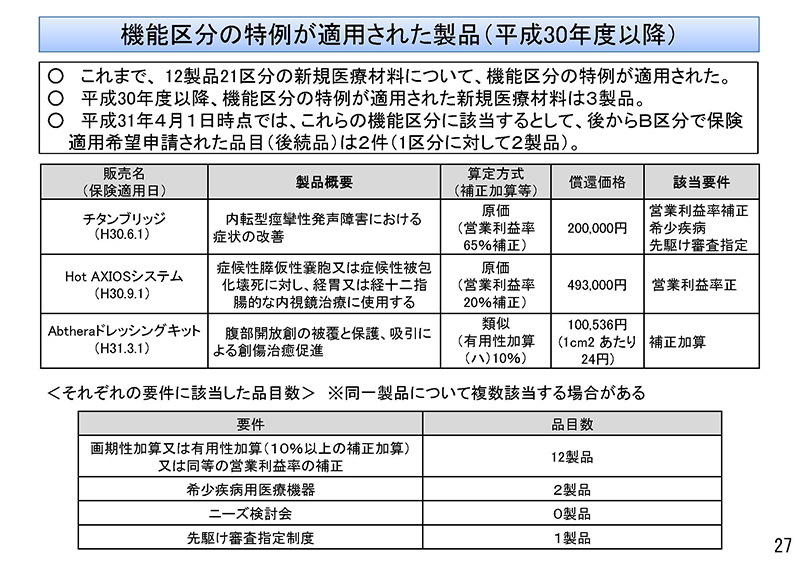
これまで、12製品21区分の新規医療材料について「機能区分の特例」が適用され、平成30年度以降、「機能区分の特例」が適用された医療材料は3製品でございます。
平成31年4月1日時点では、これらの機能区分に該当するものとして、あとからB区分で保険適用希望申請された品目は2件でございました。
以上より、「論点」といたしまして、機能区分の特例が適用された機能区分に該当するものとして、あとからB区分で保険適用希望申請された品目は、限定的ではございますが、革新性の高い製品の開発のインセンティブになっていることも踏まえまして、「機能区分の特例」については、引き続き継続をすることとしてはどうか、と書かせていただいております。
説明 ── ④ 先駆け審査指定制度に指定された製品の評価
続きまして、「先駆け審査指定制度に指定された製品の評価」でございます。30コマ目は、先駆け審査指定制度について説明をしたものでございます。真ん中には、「医療機器等の指定基準」を記載をしております。
.

世界に先駆けて、革新的医薬品・医療機器、再生医療等製品を日本で早期に実用すべく、世界に先駆けて開発され、早期の治験段階で著明な有効性が見込まれる医薬品等を指定し、各種支援により早期の実用化を目指す本制度が創設され、
そのためにはですね、製品の画期性、対象疾患の重篤性、対象疾患に係る極めて高い有効性、世界に先駆けて日本で早期開発・申請する意思の有無が評価の対象となっております。
.
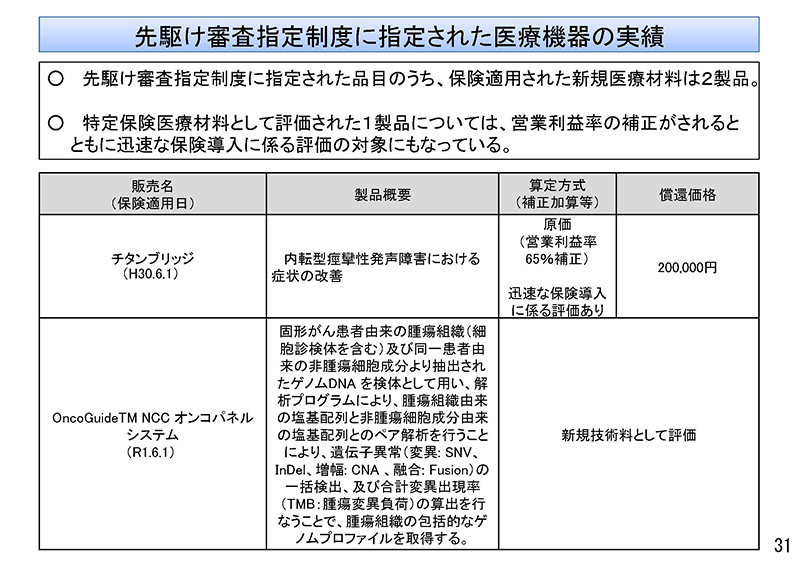
31ページにございますように、本制度に指定された品目のうち、保険適用されました新規医療材料は2製品でございます。特定保険医療材料として評価された1製品については、営業利益率の補正がなされるとともに、「迅速な保険導入に係る評価」の対象にもなっております。
32ページ目をご覧ください。先駆け審査指定制度に指定された製品の評価につきましては、平成30年度改定において、これを「機能区分の特例」の対象に加えたところでございます。
.
.
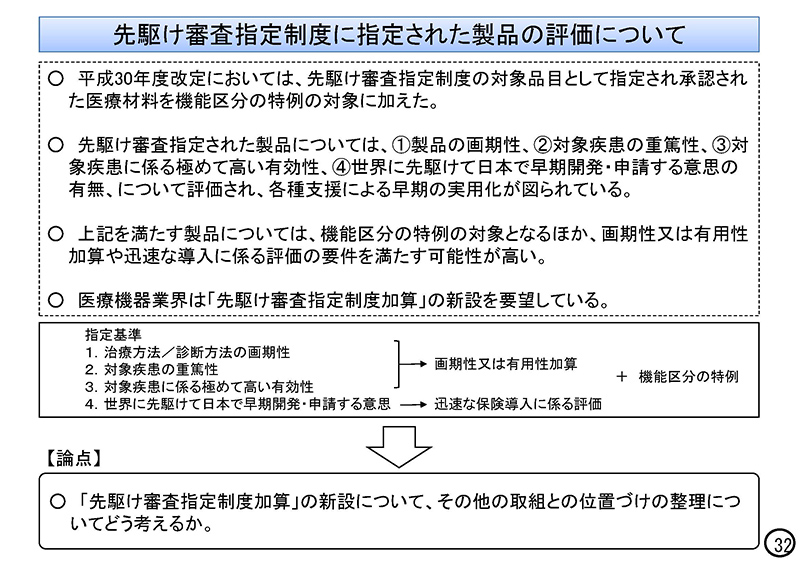
また、本指定の要件を満たす製品については「機能区分の特例」の対象となるほか、画期性または有用性加算や、「迅速な導入に係る評価」の要件を満たす可能性も高いというふうに考えております。
これに対しまして、業界からのヒアリングでは、「先駆け審査指定制度加算」といったような新設の要望もなされているところでございます。
以上を踏まえまして「論点」として、「先駆け審査指定制度加算」の新設については、その他の取組との位置づけの整理についてどう考えるか、というふうに掲げさせていただきました。以上でございます。
質疑 ── 日本医師会(意見と質問)
〇関ふ佐子部会長(横浜国立大学大学院国際社会科学研究院教授)
ありがとうございました。それでは、ただいまの説明に関して、ご質問等ありましたら、お願いします。はい、城守委員。
.
〇城守国斗委員(日本医師会常任理事)
ありがとうございます。何点か、コメントをさせていただきたいと思います。
まず17ページのですね、ニーズ選定されたにもかかわらず開発に至らなかった品目への対応についてですが。
▼ 「ですね」は以下、城守氏の発言では必要な限りで省略する。
.

今、ご説明があったとおり、さまざまな取組をされておられて、その効果もおありだと思うんですけども、現時点においては、14ページにございますように、開発に至らない品目数は減少傾向にあるということで、それに対して、今後の実態を踏まえた、必要に応じて検討をすると。そういう論点の方向で、引き続き対応を図っていただければよいかなと思います。
ただ、開発に至らない品目について、企業の意図的なものなのか、さらには医療現場においてのニーズが変化したかどうかと。そういう精査というものは、引き続いてお願いしたいと思います。
そして、23ページ。23ページの「迅速な保険導入に係る評価」についてでございますが、
.

これは今、説明があったように、PMDAの中期計画において、目標期間は申請側、審査側の両者を合わせた期間という形になってございますが、19ページを見ると、「迅速な保険導入に係る評価」の枠組みにおいては、申請者側の期間だけとなっております。
.

この審査期間の、今回、この短縮を要件にはされるということで、それは申請側のインセンティブになると思うんですが、そうしますと、行政側の審査期間が短くなると、それでも加算が付いてしまうというスキームになってしまうということがございますので、逆に、そのあたりがどうなのか。
また、この、申請側の、要するに対応ということだけであれば、もちろんPMDAはしっかりと対応は、これまでしてきてこられて、デバイスラグもなくなってきてるわけですが、さらなる取組のインセンティブが働きにくくなるのではないかなということもあるので、そのあたり、どういうふうに考えておられるのかというのは、ちょっとお聞きしたいと思います。
そして、もう1点だけ。32ページでございますが、先駆け審査指定制度の加算の点でございますけれども、この迅速評価との関係ということであれば、海外よりも日本でいち早く開発される製品を増やすということと、海外に遅れる製品を減らすということのどちらも大切だろうというふうに、もちろん考えております。
.

その点では、先駆け審査指定制度は、海外よりも日本でいち早く開発される製品を増やすもの。そして迅速な保険導入に係る評価制度というものは、それらに加えて、海外に遅れる製品を減らすという評価もされているということ。
ということを考えますと、両制度の位置付けというのは、そのあたりで整理をしていただいたらよいかなというふうに思います。
そして、先駆け審査指定制度の該当品目に関しては、今、説明がございましたように、例えば「迅速な保険導入に係る評価」とか、「機能区分の特例」とか、複数の評価がされる可能性が非常に高い品目が多いということでございますので、先駆けの指定をされれば、世界に先駆けて承認を得るということを目標に、開発とか、そして審査の段階で優遇がされるわけですので、いわゆる評価の二重取り、三重取りという形については、やはり認めないという方向で検討すべきではないかと考えております。以上です。
.
〇関ふ佐子部会長(横浜国立大学大学院国際社会科学研究院教授)
2点目について、事務局、お願いします。
.
〇厚労省保険局医療課医療技術評価推進室・岡田就将室長
医療技術評価推進室長でございます。ご質問、ありがとうございます。
「迅速な保険導入に係る評価」につきまして、ちょっと私の説明が分かりにくかったと反省しておりますが、こちらの評価の枠組みは、「申請者側の期間」を要件に、19ページ目でございますけれども、
.

審査機関のうち、「申請者側の期間」の日数が要件となっておりますので、PMDAの計画にある総審査期間のうち、審査期間が短くなったことをもって、その企業に有利になるという形ではなく、企業としての持ち時間の要期間をきちんと守っていただくということを要件にしたという制度となっております。
.
〇城守国斗委員(日本医師会常任理事)
了解しました。そういう意味では、申請者側のインセンティブが働くということですが、先ほども申しましたように、PMDAも事務局がされておられると思いますが、一層の審査側の努力を、しっかりと評価というよりはチェックをするということも念頭に置いて、制度設計をお願いしたいと思います。ありがとうございます。
.
〇関ふ佐子部会長(横浜国立大学大学院国際社会科学研究院教授)
ほか、いかがでしょうか。はい。お願いします。林委員。
質疑 ── 日本歯科医師会(質問)
〇林正純委員(日本歯科医師会常務理事)
ありがとうございます。1つ、事務局に質問なんですけれども、16ページでございます。
.

この、「ニーズ選定品目に係る各種制度の利用状況」ということで、①、②、③がございますが、この③に関しまして、利用実績がないということでございますが、何か、この制度でハードルが高いとか、そういった理由はございますでしょうか。
.
〇関ふ佐子部会長(横浜国立大学大学院国際社会科学研究院教授)
はい、室長。
.
〇厚労省保険局医療課医療技術評価推進室・岡田就将室長
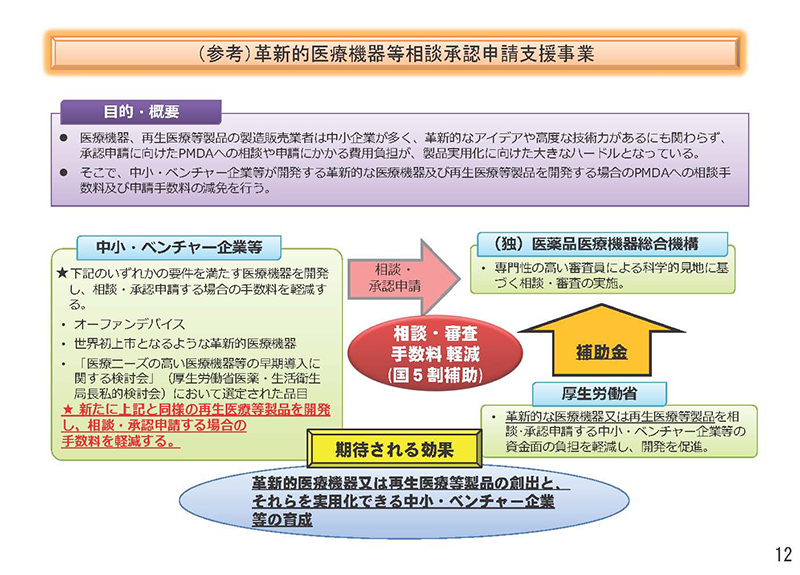
ご質問、ありがとうございます。構造的に何か難しいというような認識というよりはですね、これまでニーズ選定品がありまして、それと、このベンチャー等の「革新的医療機器等相談承認申請支援事業」がマッチした品目がないという状態かなというふうに、事務局としては認識をしております。
.
〇林正純委員(日本歯科医師会常務理事)
はい、ありがとうございます。そういった構造的な問題がなければ、問題ないと思いますけれども、もし理由がありましたら、今後、改善していかれるよう、よろしくお願いいたします。
.

〇関ふ佐子部会長(横浜国立大学大学院国際社会科学研究院教授)
ほかはよろしいでしょうか。はい、幸野委員。
質疑 ── 健康保険組合連合会(意見と質問)
〇幸野庄司委員(健康保険組合連合会理事)
全ての論点において、方向性としてはいいと思うんですが、最後の、「先駆け審査指定制度」に指定された製品の評価については、これは薬価と平仄を合わせるという観点から理解するんですけど、
ここに書いてあるとおり、この指定された製品というのは、画期性加算や有用性加算の要件を満たしている可能性が高いということから、二重の評価になる可能性があるので、加算を付けるということについては、やはり慎重に検討を進めるべきだというふうに思います。
あと、もう1つは、ニーズ選定にもかかわらず開発に至らない品目のことについて、ちょっと質問をしたいんですが、1つは、なぜ開発に至らないのか。開発する技術があっても利益等が得られないからインセンティブが湧かないということなのか、それとも技術的に困難で、努力はしてるんですけど駄目なのか、こういう状況、どっちなのかというのを教えていただきたいというのと、
あとは、ニーズ選定されて、長期にわたって開発されない場合に、医療の現場がどうなってるのか。非常に混乱に陥ってるのか、それとも長期にわたって開発されなくても、やっていけてるんであれば、本当にニーズの高いものなのかどうかっていうふうなところ、再度検証されてるのか。そのへんについて、ちょっと教えていただきたいというふうに思います。
.
〇関ふ佐子部会長(横浜国立大学大学院国際社会科学研究院教授)
はい。
質疑 ── 厚労省医療機器審査管理課・中井課長(回答)
〇厚労省医薬・生活衛生局医療機器審査管理課・中井清人課長
医療機器審査管理課長でございます。開発が進まない理由については、さまざまあるかと思います。
まずは1つは、海外の製品であって、日本で当該企業がなかったりする場合。それから、1つはやっぱり、どうしても大きいのが、全く利益が出ないということで躊躇する場合。
それから、あと、また、もう1個、具体・実務的に言いますと、幾つかそういう品目があって、なかなかそこに手が回らない場合っていうのも、実際、あることはあります。
そういった品目の中において、われわれとしては、なるべく承認審査の中にハードルというのを、どこまで学会のガイドラインなり何なり、いろいろ検討していただいた上で、承認審査のハードルというのを、「下げる」という表現はよくないんですけども、「適正化するか」ということは議論させていただいております。
そういった観点で、個別品目について企業が何を望むかというのを1個1個、議論をしていって、今回、幾つか、なんとか開発を進めてるっていう状況になってるかと思います。
ただ、そうは言いながらも、なかなか本当に難しいやつもあるのも事実です。それは本当に海外の製品で、日本で支社がなくて、日本でも、なかなかそれを開発しようと思わない。かつ、全く利益も出ないというのがあるのも事実だと思います。それをどうするかっていうのはあるんだというふうに、課題として残ってると思います。
それから、学会の先生方も幾つかニーズ取り下げっていうのも、幾つか入ってると思うんですが、これはいろいろニーズはあったんです。その後、幾つか開発されてるうちに、そのニーズをほかの製品でなんとか賄えるといったものもあるかというふうに思ってます。
それから最後に、ご質問いただきました、じゃあ、このニーズがない場合、学会はどうしてるのかっていうのは、個別個別だとは思うんですけれども、それは今、現状、ほかの方法で何らかの形でやっていただいてるっていうことだと思って。
ただ、それがいいというふうに私ども、思ってるわけではございませんので、なるべくそのニーズに沿うように、1個1個、なんとか、協力できる企業とも議論をしていって、有効性・安全性を確保しながら進めていきたいというふうに、今のところ、思っているということであります。
.
〇関ふ佐子部会長(横浜国立大学大学院国際社会科学研究院教授)
幸野委員。
質疑 ── 健康保険組合連合会(意見)
〇幸野庄司委員(健康保険組合連合会理事)
ありがとうございます。いろいろ事情があるというのは、よく分かりましたけど、やっぱり企業には社会的責任、CSRっていうのがありますので、本当にニーズの高いものであれば、企業の社会的責任をもって開発を指導していただきたいというところと、
やはり利益が出ないからっていうふうに放置している所については、何らかのディスインセンティブを個別に検討してもいいんじゃないかなあというふうには思います。以上です。
.
〇厚労省医薬・生活衛生局医療機器審査管理課・中井清人課長
前者については、後者のほうは、ちょっと別として、前者については1個1個、ご指摘踏まえまして議論させていただきたいというふうに思っております。
.
〇関ふ佐子部会長(横浜国立大学大学院国際社会科学研究院教授)
ほかはよろしいでしょうか。ありがとうございました。
ほかに、ご質問等ないようですので、本件の議論はここまでとさせていただきます。本日の予定された議題は以上です。なお、次回の日程につきましては、追って事務局より連絡いたしますので、よろしくお願いします。
それでは、本日の保険医療材料専門部会は、これにて閉会といたします。
(約5分間の休憩後、総会へ)


_2019年9月11日の中医協・保険医療材料専門部会2.jpg)








_2019年9月11日の中医協・保険医療材料専門部会2.jpg)












【速記録】_ページ_01-のコピー.jpg)
【速記録】_ページ_01-のコピー.jpg)
【速記録】_ページ_01-のコピー.jpg)
_2023年8月2日の総会-1-190x190.jpg)

_2023年6月21日の中医協総会-190x190.jpg)








_2022年8月3日の中医協総会-190x190.jpg)















-190x190.jpg)


_20190807_中医協材料ヒアリング-300x300.jpg)





























