厚生労働省は9月11日、中医協の薬価専門部会(部会長=中村洋・慶應義塾大大学院経営管理研究科教授)を約2カ月ぶりに開き、次期薬価制度改革の骨子とりまとめに向けて具体的な議論をスタートした。厚労省は、前回7月24日の同部会で実施した関係業界のヒアリングを踏まえ、9項目の検討事項を整理。同日の部会では、これらの検討項目のうち「薬価算定方式の妥当性・正確性の向上」「イノベーションの評価」について論点を示し、委員の意見を聴いた。【新井裕充】
.
- 説明 ── 次期制度改革のスケジュール
- 説明 ── 1.薬価算定方式の正確性・妥当性の向上
- 説明 ── 2.イノベーションの評価
- 質疑(前半)── スケジュール、配合剤、再生医療等製品
- 質疑(後半1)── 新薬創出等加算対象品目を比較薬とする場合の薬価算定
- 質疑(後半2)── イノベーションの評価
.
厚労省は同部会の冒頭で、「次期薬価制度改革の検討スケジュール(案)」を示した。厚労省保険局医療課の田宮憲一薬剤管理官は「今後、年末に向けて、おおむね月に2回程度のペースで検討し、次期薬価制度改革に向けて議論を深めていくこととしてはどうか」と提案。検討項目については、今回示した事項に「限られるということではない」とした上で、「11から12月までに骨子のたたき台のようなものを提示した上で関係団体ヒアリングをして、12月に骨子のとりまとめを行いたいと考えている」と述べた。反対意見はなかった。
9項目の検討事項のうち、今回のテーマに挙げられたのは、1.薬価算定方式の妥当性・正確性の向上、2.イノベーションの評価──の2項目。
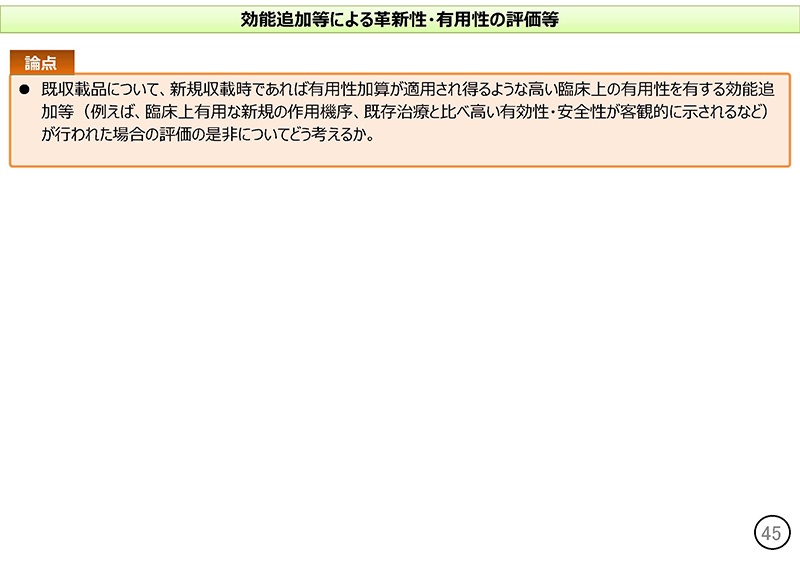
このうち1.では、配合剤、再生医療等製品、新薬創出等加算対象品目を比較薬とする場合について「論点」を示した。2.では、「既収載品について、新規収載時であれば有用性加算が適用され得るような高い臨床上の有用性を有する効能追加等が行われた場合の評価の是非についてどう考えるか」との論点を挙げた。
会合では、1.と2.について整理した資料について田宮薬剤管理官が約30分間にわたって説明した。これに続く質疑は、いくつのパートに分けるかで若干の混乱が見られた。
中村部会長は、1.の「新薬創出等加算対象品目を比較薬とする場合の薬価算定」と、2.の「効能追加等による革新性・有用性の評価」を分けて議論する意向だったようだが、支払側委員はこれらをセットで議論する認識だったようで、両者のズレが表れる場面があった。これが本日、最大の見所かもしれない。
やや分かりにくいが、「新薬創出等加算対象品目を比較薬とする場合の薬価算定」は1.の最後に挙げられている。一方、「効能追加等による革新性・有用性の評価」は2.の最初に挙げられている。資料の上では、境界線が引かれているようにも見える。
本稿で質疑の流れを3分割にするか、2分割にするか迷うところだが、会議の流れに従い、「再生医療等製品の価格算定」までを前半とし、それ以降を後半1と2に分けたい。
Contents
説明 ── 次期制度改革のスケジュール
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
ただいまより、第155回中央社会保険医療協議会「薬価専門部会」を開催いたします。本日の委員の出欠状況について、ご報告いたします。本日は全員がご出席です。なお、会議冒頭のカメラの頭撮りはここまでとさせていただきます。よろしくお願いします。
それでは、議事に入らせていただきます。本日は、次期薬価制度改革について薬価算定方式の正確性・妥当性の向上、イノベーションの評価について検討していきたいと思います。事務局より資料が提出されておりますので、説明のほうをお願いいたします。では薬剤管理官、お願いいたします。
.
〇厚労省保険局医療課・田宮憲一薬剤管理官
はい。資料「薬ー1」をご覧ください。「次期薬価制度改革の検討スケジュール(案)」ということでお示ししております。これまで薬価専門部会におきまして、薬価算定組織からの意見の聴取、それから関係団体のヒアリング等を行ってまいりました。
今後、年末に向けまして、おおむね月に2回程度のペースで、下に記載した検討項目などについて検討を行い、次期薬価制度改革に向けて議論を深めていくこととしてはどうか、というご提案でございます。
具体的な検討項目でございますけれども、ここに限られるということではございませんが、まず「薬価算定方式の妥当性・正確性の向上」という点では新薬創出等加算品目を比較薬とする場合の薬価算定、再生医療等製品の価格算定、原価計算方式、配合剤などの議論、それからイノベーションの評価につきましては効能追加等による革新性・有用性の評価等に関する議論、それから新薬創出・適応外薬解消等促進加算制度そのもの、企業要件、品目要件等についての議論があろうかと思っております。
また、右側でございますけれども、長期収載品の段階的引下げまでの期間が在り方、再算定、後発品の薬価の在り方、基礎的医薬品への対応の在り方、また2020年度改定における実勢価の反映といった検討項目がございます。
その他、後発バイオ医薬品の取扱いなどについて検討して、11から12月までに骨子のたたき台のようなものを提示した上で関係団体ヒアリングをして、12月に骨子のとりまとめを行いたいと考えているところでございます。
説明 ── 1.薬価算定方式の正確性・妥当性の向上
続きまして、「薬-2」をご覧ください。早速、本日でございますけれども、議題を2つ用意させていただいております。
1つが、薬価算定方式の正確性・妥当性の向上。それから2つ目がイノベーションの評価ということでございます。
まず2コマ目でございますけれども、配合剤に関する議論でございます。
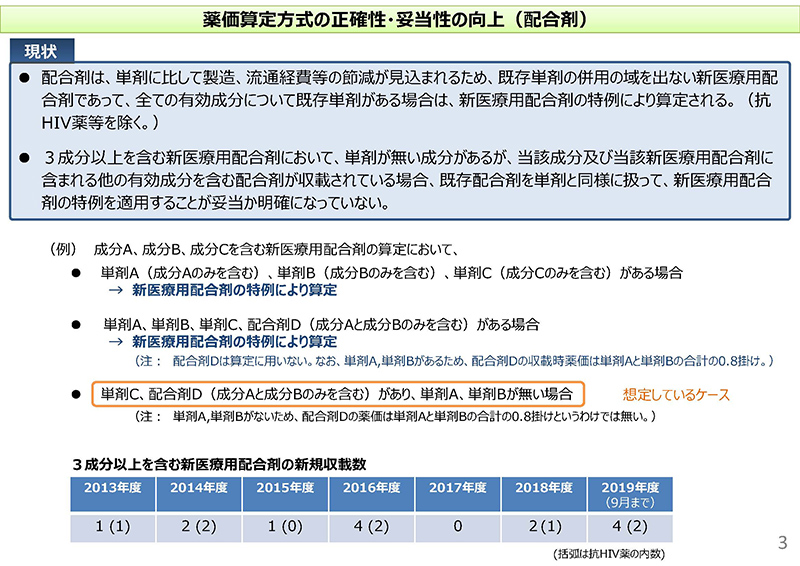
3コマ目をご覧ください。現行、配合剤につきましては既存単剤の併用の域を出ない新医療用配合剤であって、全ての有効成分について既存単剤がある場合には、新医療用配合剤の特例、すなわち単剤の合計の0.8掛けにより算定をするというルールがございます。
近年、3成分以上を含む新医療用配合剤が出てきておりますけれども、その場合に単剤が薬価収載されていない成分がある。他方、当該成分および当該新医療用配合剤に含まれる他の有効成分を含む配合剤が薬価収載されているといったような、さまざまなケースが出てきているわけでございまして、
この場合にですね、この既存配合剤を単剤と同様に扱って、新医療用配合剤の特例を適用することが妥当かどうか、ということが現行のルール上、明確になっていないということでございます。
具体的にはですね、下に「想定しているケース」ということで枠囲みがございますけれども、単剤のCというものが薬価収載されていて、それから配合剤でD、こちらは成分Aと成分Bのみを含むもの、これが薬価収載されているケースでございますけれども、一方、単剤のAとかBは薬価収載されていない。
こういった場合に、単剤Cと配合剤Dを用い、新医療用配合剤の特例ルールを適用してよいかというところが明確になっていないという問題がございます。
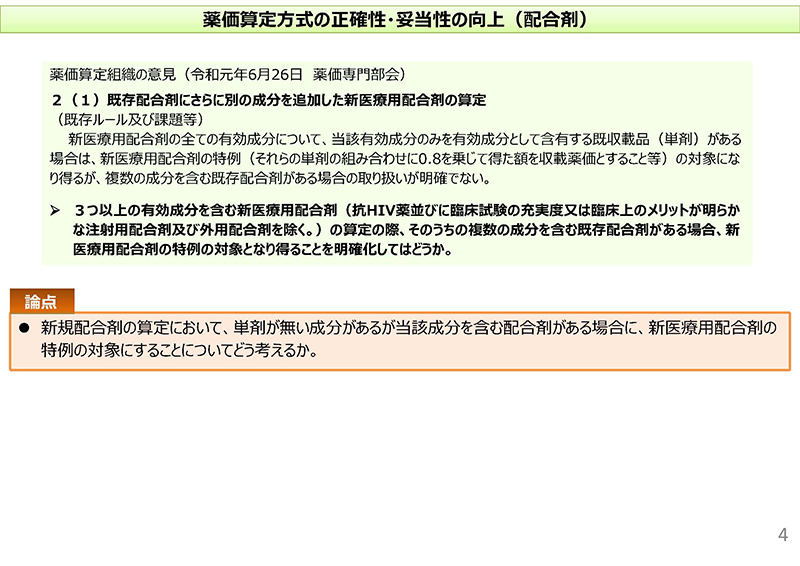
この点につきましては4コマ目でございますけれども、先日の薬価算定組織からも同様の意見が提出されたというところでございます。
従いまして、論点といたしましては、新規配合剤の算定において単剤が薬価収載されていない成分があるけれども、当該成分を含む配合剤が薬価収載されている場合に、新医療用配合剤の特例の対象にすることについてどのように考えるか、ということを述べさせていただいているところでございます。
5コマ目は、現行のルールについての資料でございます。
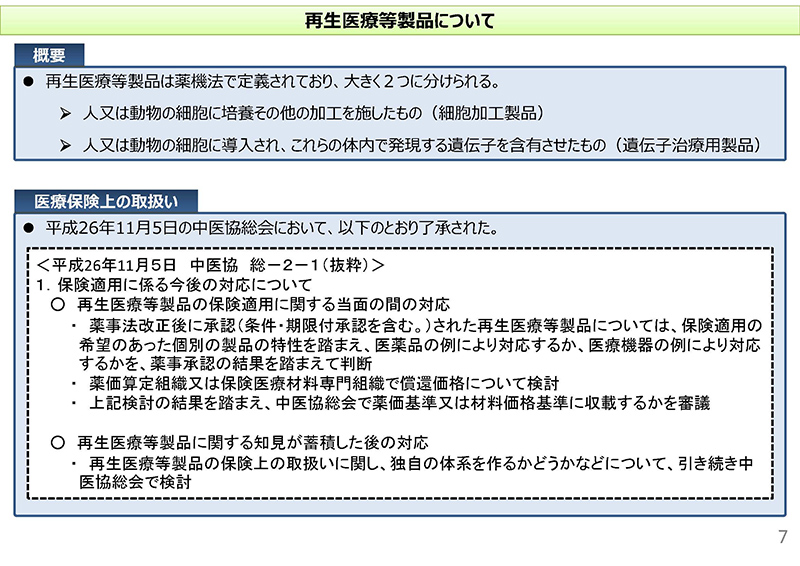
続きまして、6コマ目から再生医療等製品の価格算定についてでございます。7コマ目をご覧ください。再生医療等製品につきましては薬機法で定義されておりまして、大きく2つに分けられます。
1つが細胞加工製品、もう1つが遺伝子治療用製品ということになります。再生医療等製品の医療保険上の取扱いでございますけれども、平成26年11月5日の中医協総会において、以下のような取り扱いとすることが了承されております。
具体的には、当面の間の対応といたしまして、再生医療等製品については保険適用の希望のあった個別の製品の特性を踏まえ、医薬品の例により対応するか、医療機器の例により対応するかを承認の結果を踏まえて判断する。それを踏まえて薬価算定組織または保材専(保険医療材料専門部会)で償還価格について検討し、最終的に中医協総会で審議するという形になってございます。
また、再生医療等製品に関する知見が蓄積した後の対応ということで、独自の体系を作るかどうかなどについて、引き続き中医協総会で検討するとされております。
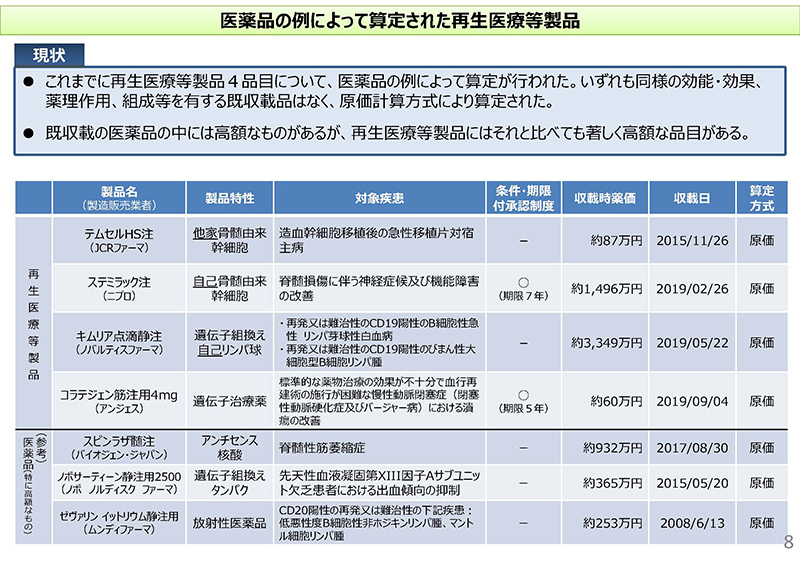
8コマ目をご覧ください。これまで再生医療等製品4品目についてですね、医薬品の例によって算定が行われております。いずれも同様の効能・効果等を有する既収載品がないので原価計算方式により算定されたというものでございます。
これら4品目、下に表で記載しておりますけれども、それぞれ製品特性がございまして、例えばテムセルの場合ですと、「他家」の骨髄由来幹細胞、ステミラック注ですと「自己」の骨髄由来幹細胞。キムリア点滴静注ですと、遺伝子組換えの自己のリンパ球、またコラテジェンにつきましてはプラスミドDNAを主成分とする遺伝子治療薬ということでございます。
それから条件・期限付承認制度の対象となっているのがステミラックとコラテジェンの2品目ということで、収載時の価格をご覧いただければと思いますけれども、下のほうに3品目ほど、医薬品で高額な例を記載しておりますが、これらと比べてもですね、ステミラックあるいはキムリアにつきましては、かなり高額になっているという状況でございます。
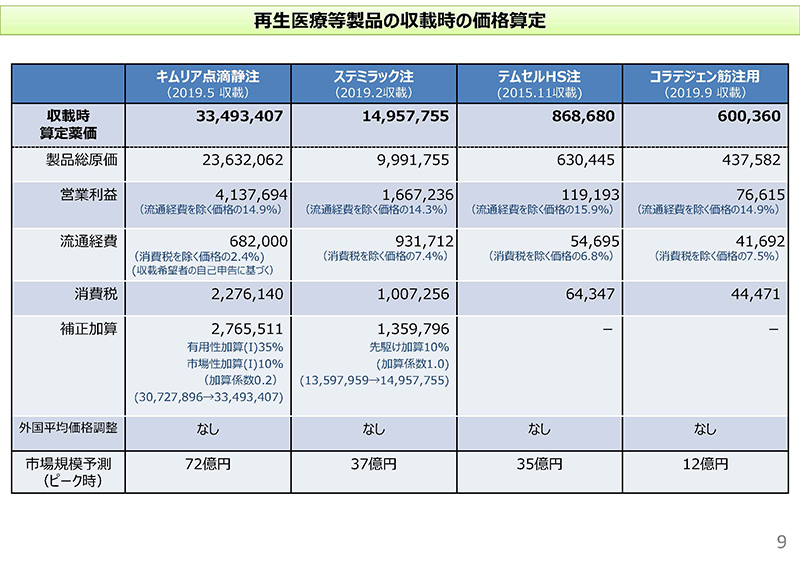
9コマ目に、これら再生医療等製品4品目について、原価計算方式で算定されたものの内訳について記載してございます。「製品総原価」という所が製造原価または輸入原価に、一般管理・販売費を加えた金額ということでございますけれども、それに「営業利益」「消費税」「補正加算」を適用して算定しているわけでございます。
一点、「流通経費」の所をご覧いただければと思いますけれども、キムリアの場合には、通常は統計的な一定の係数を使用するわけですけれども、収載希望者の自己申告に基づくパーセンテージで計上しているということがお分かりいただけるかと思います。
10コマ目は現行の原価計算方式のルールでございます。
11コマ目をご覧いただければと思います。再生医療等製品につきましては、その適正使用を促すということから「最適使用推進ガイドライン」ですとか、あるいは「保険適用上の留意事項通知」により適正使用を図っているところでございます。
例えば、キムリアでございますと「最適使用推進ガイドライン」を定めまして、実施施設あるいは投与対象患者などについて厳格に規定しているということ。
また、コラテジェンにつきましては「最適使用推進ガイドライン」を作成しておりませんけれども、添付文書等の内容を踏まえまして、実施施設あるいは投与対象患者について留意事項通知を発出しているという状況でございます。
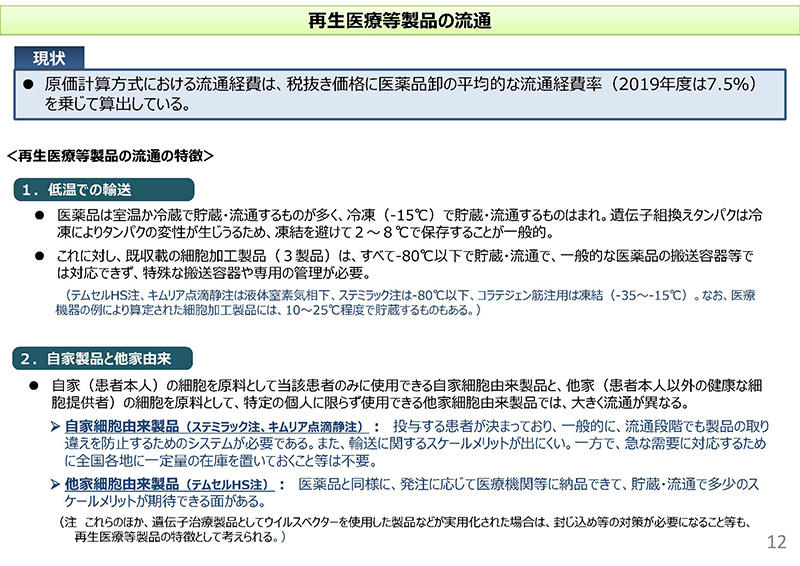
続いて12コマ目をご覧ください。まず、再生医療等製品の流通についてまとめております。現行の原価計算方式におきましては、医薬品卸の平均的な流通経費率、2019年度は7.5%ですけれども、これを乗じて算出するというルールになってございます。
一方、再生医療等製品の流通の特徴ということでまとめておりますけれども、1つは低温での輸送が求められるというケースが多いということでございます。
医薬品の場合ですと、室温か冷蔵で貯蔵・流通するものが多いんですけれども、既収載の細胞加工製品、3製品については全てマイナス80度以下で貯蔵・流通。また、特殊な搬送容器や専用の管理が必要といったような状況にございます。
また、2番目としまして、自家製品と他家由来の製品で、だいぶ特性が異なるということでございまして、流通も大きく異なるということでございます。
具体的には、自家細胞由来製品のステミラックおよびキムリアの場合ですと、投与する患者が決まっており、一般的に流通段階でも製品の取り違いを防止するためのシステムが必要であると。また、輸送に関するスケールメリットが出にくいということがございます。
一方で、急な需要に対応するために全国各地に一定量の在庫を置いておくといったようなことは不要になるという特徴がございます。
一方、テムセルHSのような他家細胞由来製品ですと、医薬品と同様に発注に応じて医療機関等に納品できて、貯蔵・流通で多少のスケールメリットが期待できる面があるということでございます。
13コマ目をご覧ください。
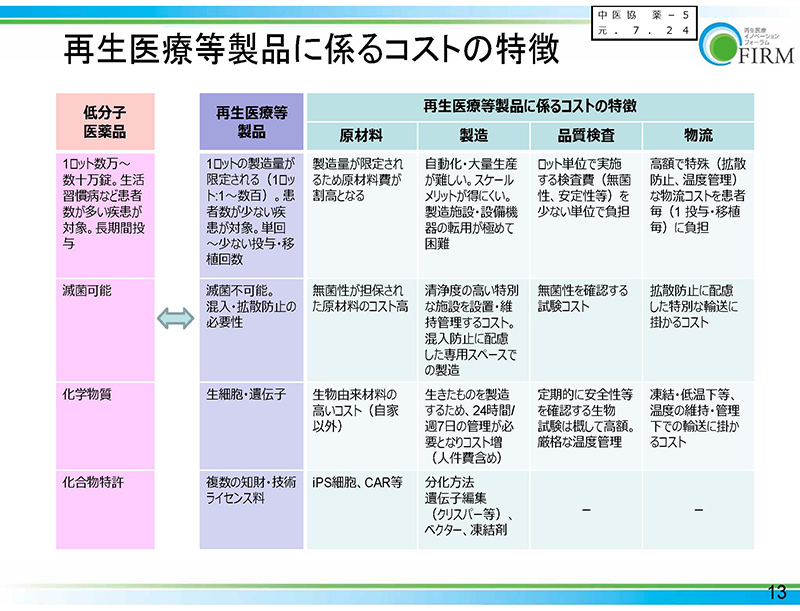
こちらは、先日の関係業界ヒアリングでFIRM(再生医療イノベーションフォーラム)から提出された資料をお示ししておりますけれども、低分子医薬品と再生医療等製品の違い、特徴ということでまとめてありますけれども、
まず再生医療等製品の場合ですと、1ロットの製造量が限定されるといったようなこと。また、「製造」の欄をご覧いただければと思いますけれども、「自動化、大量生産が難しくて、スケールメリットが得にくい」とかですね、そういった特性もあろうかと思います。
また、その横の「品質検査」に書いてございますとおり、ロット単位で実施する検査費を少ない単位で負担するということ、頻回の検査などが必要になるというような話もございます。
また、「製造」の欄の下から2番目の所をご覧いただければと思いますけれども、細胞などを製造するために24時間、週7日の管理が必要となる。コスト増になるといったようなことも挙げられているところでございます。
これらを踏まえまして14コマ目に論点として挙げさせていただいております。
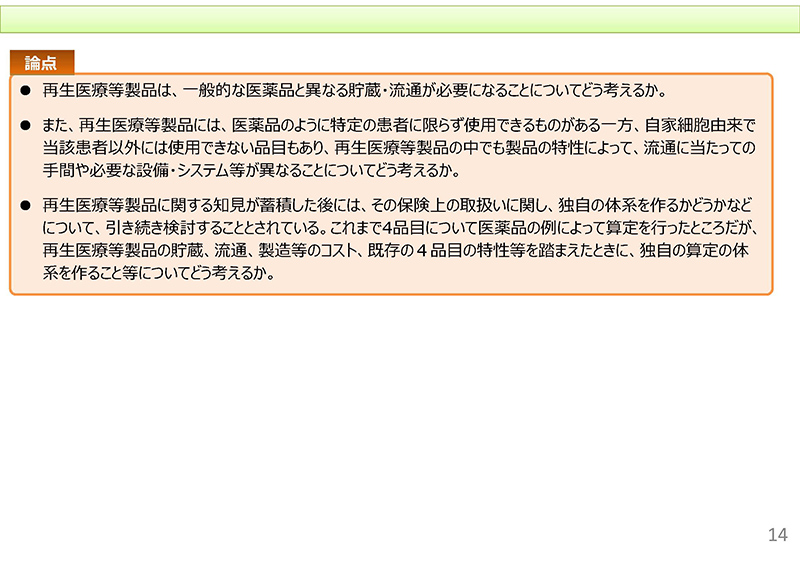
まず再生医療等製品は、一般的な医薬品と異なる貯蔵・流通が必要になるということについて、どのように考えるかということでございます。
また、これに関連しまして、再生医療等製品につきましては医薬品のように特定の患者に限らず使用できるものがある一方で、自家細胞由来製品のように当該患者以外には使用できない品目もあると。こうした製品の特性によって、流通に当たっての手間や必要な設備・システム等が異なることについてどのように考えるかということでございます。
それから3点目ですけれども、再生医療等製品に関する知見が蓄積した後には、その保険上の取扱いに関する独自の体系を 作るかどうか引き続き検討することとされておりますけれども、これまでの4品目についての例を踏まえた上で、また再生医療等製品の貯蔵・流通、製造等のコストなどを踏まえた際にですね、独自の算定の体系を作ることについてどのように考えるか、ということを挙げさせていただいております。
続いて、15コマ目をご覧ください。今度は、再生医療等製品の収載時の補正加算についてでございます。
新規収載時の補正加算額は加算前の価格に比例して計算するということになっておりますので、単価が高額な場合には加算額もそれに応じて大きくなるということでございます。
過去の薬価算定におきましては、1日薬価の額の大きさに応じて有用性加算の補正加算率を0.5倍から1.5倍までの範囲で傾斜配分していた時期もございました。
具体的には米印の1ですけれども、平成20年改定以前は1日薬価が標準額より高ければ低い加算率にするなどしていたということでございますけれども、その後、加算の傾斜配分については1日薬価でなく市場規模で考えることが適切という議論がございまして、20年度改定で廃止されたという経緯がございます。
一方、現在では既収載品の薬価改定時の加算。収載後に行われる小児加算、希少疾病用の加算などについてのみ、市場規模に応じた傾斜配分を行なっております。
米印2にございますとおり、内用薬、外用薬は市場規模50億より大きい場合、注射薬は20億より大きい場合に補正加算率を下げるといったルールがございます。この点については、薬価算定組織からも問題提起されたということでございます。
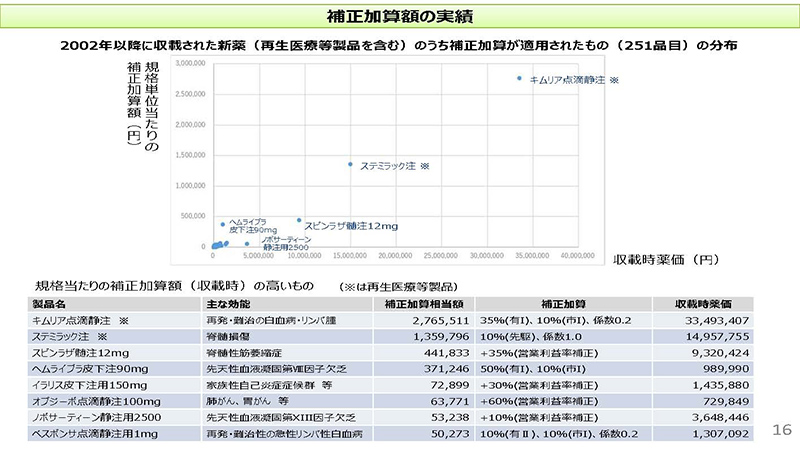
16コマ目をご覧ください。2002年以降に収載された新薬のうち、補正加算が適用された251品目についてです。横軸を収載時薬価、縦軸を規格単位当たりの補正加算額ということで整理したグラフでございます。
ご覧いただきますと、ほとんどの品目は左下に重なっているわけでございますけれども、一部の医薬品ではヘムライブラ、ノボサーティーン、スピンラザのように単価あるいは補正加算額が大きなものもございます。
ただ、ご覧いただくと分かりますけれども、ステミラック注、それからキムリア点滴静注の2品目につきましては、かなり補正加算額も大きくなっているということがお分かりいただけるかと思います。
17コマ目は、関連して新規収載時の補正加算に関するルール、それから18コマ目は既収載品の薬価改定時の加算ルールを挙げてございます。
19コマ目をご覧ください。そこで「論点」ということでございますけれども、
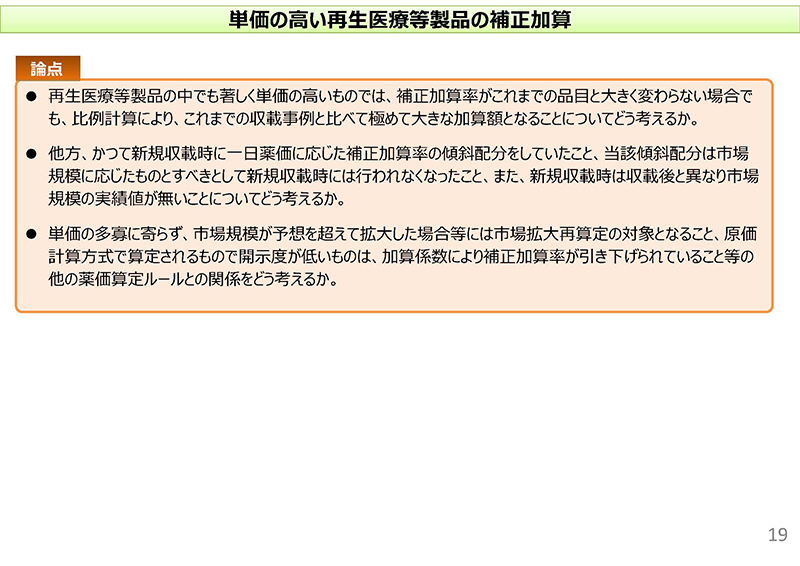
まず、再生医療等製品の中でも著しく単価の高いものでは補正加算率がこれまでの品目と大きく変わらない場合でも、比例計算により、これまでと比べて極めて大きな加算額となることについてどう考えるか、というのが1点目。
他方、かつて新規収載時に1日薬価に応じた補正加算率の傾斜配分をしていたけれども、当該傾斜配分は市場規模に応じたものとすべきといった議論があって行われなくなった経緯があること。また、新規収載時には収載後と異なり市場規模の実績値がないことについてどのように考えるか、ということでございます。
また、単価の多寡によらず市場規模が予想を超えて拡大した場合には市場拡大再算定のルールがございますし、また原価計算方式で開示度が低いものについては加算係数により補正加算率が引き下げられているといった他のルールとの関係をどのように考えるか、ということを挙げさせていただいております。
続きまして、20コマ目でございます。条件・期限付承認を受けた再生医療等製品についてでございます。
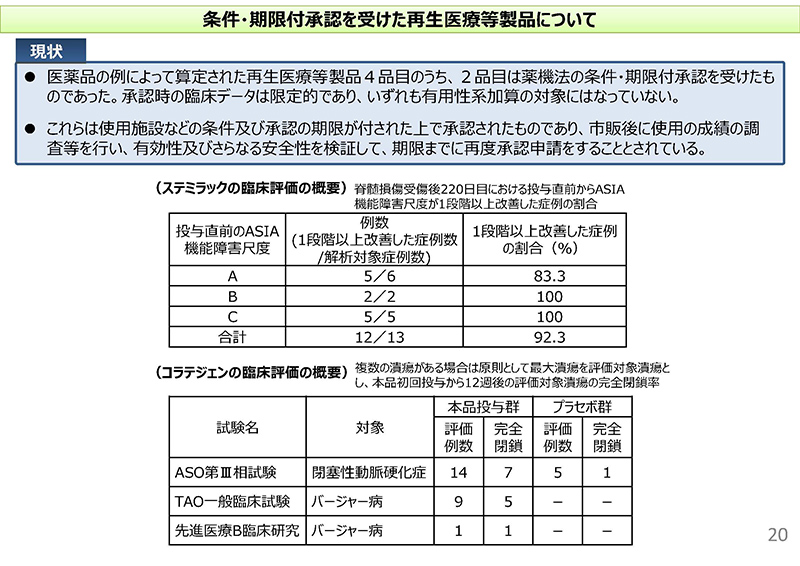
これまでの4品目のうち2品目はですね、薬機法上の条件・期限付承認を受けたものでございまして、下に臨床試験のデータの概要を書いてございますけれども、いずれも症例数が10数例から20数例ということで、検証的な形で有用性が示されていないことから有用性系加算の対象にはなっていないところでございます。
これらにつきましては、市販後に使用の成績の調査等を行って有効性および、さらなる安全性を検証して、期限までに再度承認申請をすることとされているところでございます。
21コマ目をご覧ください。この点につきまして薬価算定組織からも問題提起がされているということでございます。それを踏まえた「論点」が記載してございます。
まず、条件・期限付承認制度の特性上、承認時は臨床データが限定的だが、改めて承認を受ける際には初回承認時には明らかでなかった医療上の有用性が客観的に示されることがあり得ることについてどう考えるか、ということでございます。
それから、薬価算定組織からは、例えばベンチャー企業などが条件・期限付承認の品目を海外展開する際などには「暫定薬価」などと呼称できるようにすると海外展開しやすくなるといったような意見もあったところでございますので、条件・期限付承認を受けた品目の薬価の呼称についてどう考えるか、ということが2点目でございます。
22コマ目は、参考までに薬機法の条件・期限付承認の概念図を記載してございます。
続いて23コマ目からでございます。新薬創出等加算対象品目を比較薬とする場合の薬価算定でございます。
24コマ目をご覧ください。新薬のうち類似薬がある場合には市場での公正な競争を確保する観点から、比較薬の1日薬価と同一となるように薬価を算定しております。これが類似薬効比較方式(Ⅰ)、基本ということでございますけれども、一方で新規性の乏しい新薬については過去の数年間の類似薬の薬価と比較して最も低い価格と1日薬価を合わせるという類似薬効比較方式Ⅱがあるという状況でございます。
そこで、30年度改定におきましては類似薬効比較方式Ⅱで算定され、新薬創出等加算の対象となる品目については比較薬の新薬創出等加算の累積加算額を控除した薬価算定を行うというルールが導入されたところでございます。
具体的には、下の模式図でいきますと、「比較薬」というのが赤の実線であって、(新薬)創出等加算の対象品だとお考えいただければと思いますけれども、これがもし新薬創出等加算の対象でなければ赤の点線のように薬価が推移したであろうという仮定のもとに書いてございますが、ただいま申し上げた類似薬効比較方式Ⅱについては緑色の「収載」と書いてございますとおり、累積加算額を差し引いた形で最初の根付けをするというルールが導入されております。
一方、類似薬効比較方式(Ⅰ)、この図でいきますと青の実線でございますけれども、こちらにつきましては収載時に新薬創出等加算の対象外薬であったけれども、収載後に新薬創出等加算の対象品目となった場合の対応を含めて引き続き検討、とされているところでございます。
25コマ目でございますけれども、こちらが平成30年度抜本改革の際に提示した資料でございますけれども、2つ目の丸の所にございますとおり、新薬創出等加算の対象外の品目でも収載後にオーファン品となり、新薬創出等加算の対象品目となることがあると。それから、公平な市場競争環境の確保に影響を及ぼす恐れがあることから、このような引き続き、継続検討とされているという経緯がございます。
26コマ目から27コマ目は、類似薬効比較方式(Ⅰ)の説明、それから28コマ目は類似薬効比較方式Ⅱの現行ルール、それから29コマ目と30コマ目は新薬創出等加算についての資料を参考として入れております。31コマ目も品目要件でございます。
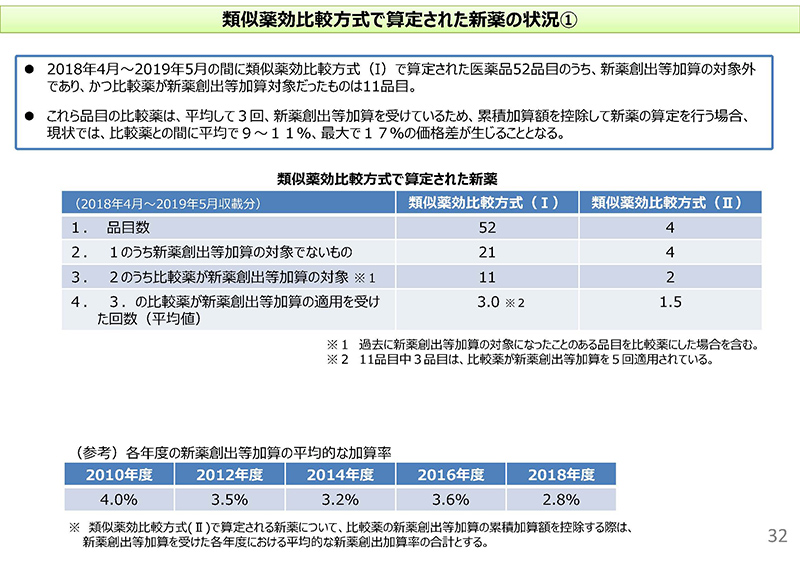
そこで、32コマ目に移っていただければと思います。類似薬効比較方式で算定された新薬の状況についてまとめたものでございます。
2018年4月から2019年5月に類似薬効比較方式(Ⅰ)で算定された医薬品が52品目ございました。そのうち、表にございますけれども、新薬創出等加算の対象外であったものは21品目。さらに、そのうちですね、比較薬が新薬創出等加算の対象であったものは11品目あったということでございます。
これら11品目の比較薬について見ますと、平均してですね、3回、新薬創出等加算を適用されているということが分かりました。
具体的には、例えばですね、下に各年度ごとの平均的な加算率がございますけれども、例えば比較薬が2014年度、16年度、18年度に新薬創出等加算の適用を受けているとすると、これらの合計9.6%分、比較薬の薬価がですね、仮に実勢価改定をしていた場合に比べて高いというような状況で、その比較薬と1日薬価を合わせているということでございます。
また、米印の2に書いてございますとおり、11品目中3品目については比較薬が新薬創出等加算を5回適用されている。合計すると約17%になりますけれども、17%高い形での比較薬の形になっているということでございますので、累積加算額を控除した新薬の算定を行う場合に、現状では比較薬との間に平均で9から11%、例えば最大で17%の価格差が生じることになるといったような状況であることが分かりました。
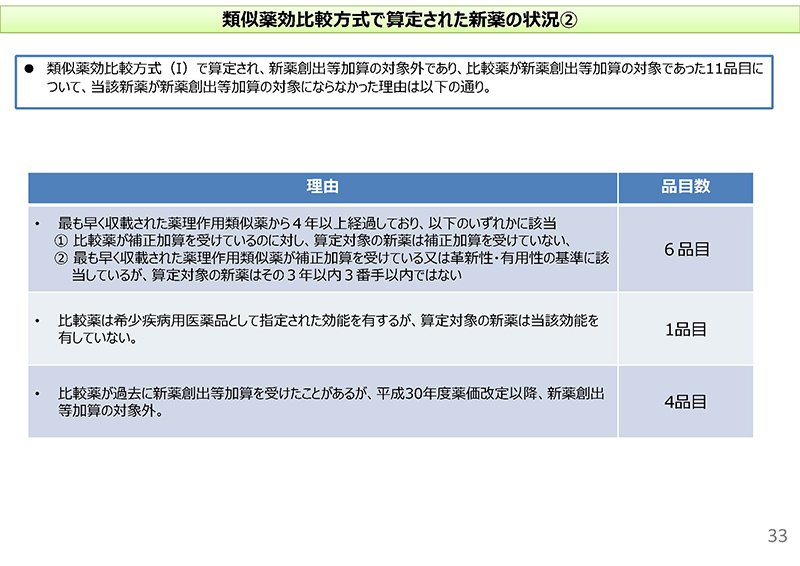
続きまして、33コマ目でございますけれども、類似薬効比較方式(Ⅰ)で算定され、新薬創出等加算の対象外である、しかも比較薬が新薬創出等加算の対象であった11品目につきまして新薬創出等加算の対象にならなかった理由について確認したものでございます。
3つほど理由が書いてございますけれども、6品目、一番多かったのはですね、最も早く収載された薬理作用類似薬から4年以上経過しておりまして、以下のいずれかに該当、とありますけれども、比較薬が補正加算を受けているが算定対象の新薬は補正加算を受けなかった、あるいは最も早く収載された薬理作用類似薬が補正加算を受けている、または革新性等の基準に該当しているけれども算定対象の新薬は3番手以内でないといったような理由が、この6品目でございました。
それから、比較薬はオーファンの効能を有するが、算定対象の新薬は有していないというのが1品目。それから、比較薬がですね、過去に新薬創出等加算を受けたことがあるけれども、30年度改定以降は要件が変わったことで新薬創出等加算の対象外になっている、こういったものも4品目あったという状況でございます。
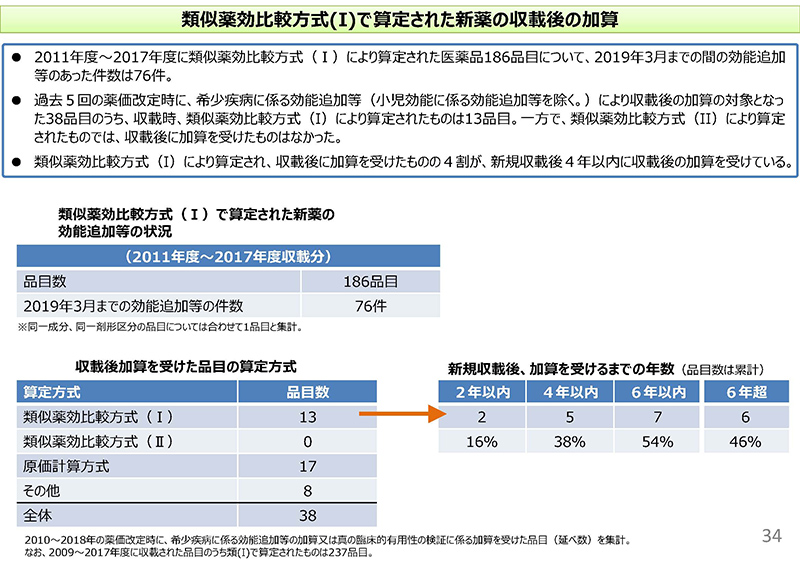
続いて、34コマ目でございますけれども、類似薬効比較方式(Ⅰ)で算定された新薬の収載後の効能追加や加算の状況についてまとめたものでございます。
まず、2011年度から2017年度に類似(薬効比較方式Ⅰ)により算定された医薬品186品目について、2019年3月までの間の効能追加の件数を確認したところ76件。約4割ほど、効能追加されていたということでございます。
また、今度は下の表になりますけれども、過去5回の薬価改定時に希少疾病にかかる効能追加等、ここでは小児効能にかかる効能追加等を除きますけれども、収載後の加算の対象となった38品目、すなわち創出等加算の対象となった38品目のうち収載時に類似薬効比較方式(Ⅰ)により算定されていたというものは13品目でございましたけれども、一方で、「類Ⅱ」(類似薬効比較方式Ⅱ)により算定されたものでは、収載後の加算を受けたものはなかったということでございます。
また、右側の表にありますけれども、「類Ⅰ」(類似薬効比較方式Ⅰ)により算定され、収載後にこの加算を受けたもののうち約38%、4割がですね、収載後4年以内に収載後の加算を受けている。54%が6年以内に加算を受けているということでございます。
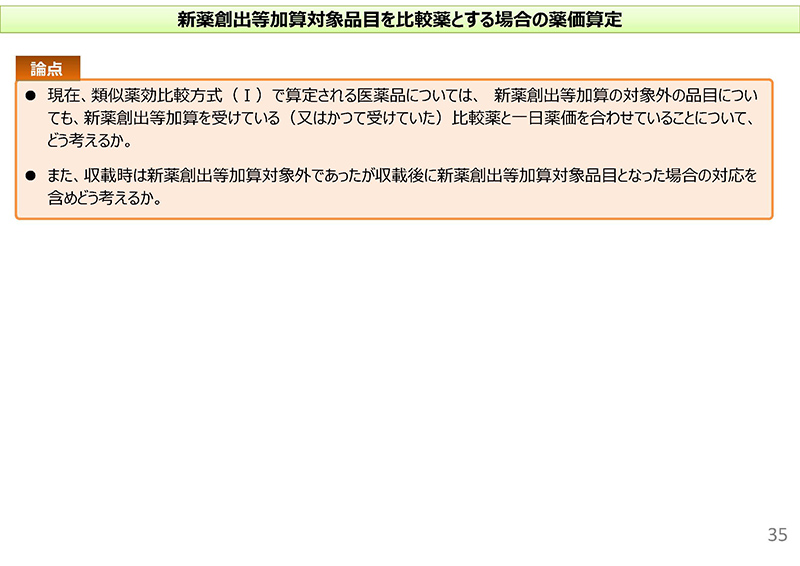
これらを踏まえまして、35コマ目に「論点」として記載しております。
現在、類似薬効比較方式(Ⅰ)で算定される医薬品につきましては、比較薬と臨床上の位置付けが同等のものとして評価しているわけでございますけれども、新薬創出等加算の対象外の品目についても新薬創出等加算を受けている、またはかつて受けていた比較薬と1日薬価を合わせることについてどのように考えるか。
また、ただいまご説明しましたとおり、「類Ⅰ」で算定された品目のうち、4割程度が収載時に効能追加を行っている。また、希少疾病等にかかる効能追加等により収載後2回、ないし3回目の改定時までに、収載後の加算を受けるような品目が一定数あることを踏まえまして、収載時は新薬創出等加算の対象外であったが収載後に新薬創出等加算の対象品目となった場合の対応を含め、どのように考えるか、ということでございます。
説明 ── 2.イノベーションの評価
続きまして、36コマ目からイノベーションの評価についてでございます。37コマ目でございます。ここに薬価算定組織からの意見を記載しておりますけれども、
収載後にですね、小児希少疾病等の効能を新たに追加した薬剤に対して、薬価改定時に加算を行うという仕組みがございますけれども、現行では、これら以外の効能追加等を評価する仕組みがないということでございます。これについて、薬価算定組織から問題提起がされているということでございます。
38コマ目は、前回の薬価制度改革、抜本改革の骨子における引き続き検討事項ということで、効能追加等による革新性・有用性の評価の是非について検討を行うこと、とされているということでございます。
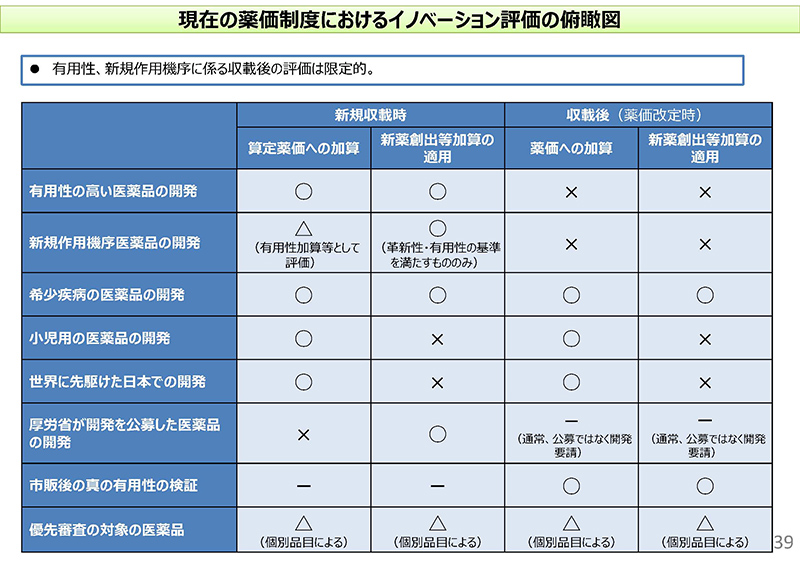
39コマ目をご覧ください。こちらは新規収載時、それから薬価収載後(薬価改定時)のイノベーションの評価に関する俯瞰図でございます。
まず、新規収載時でございます。例えば、上から1つ、2つ……、有用性の高い医薬品の開発、あるいは新規作用機序医薬品の開発の場合ですと、算定薬価への加算ということがあり得まして、その結果、新薬創出等加算の品目要件も満たして新薬創出等加算の適用もされるという状況でございます。
また、希少疾病用医薬品についても算定時の薬価の加算と新薬創出等加算の適用があるということでございます。
一方、小児用の医薬品の開発、それから世界に先駆けた日本での開発については算定時の加算はございますけれども、新薬創出等加算の適用はないということでございます。
また一番下にですね、先日、業界団体からも「優先審査の対象の品目について評価をしてほしい」といったようなご意見もございましたけれども、優先審査対象品目については上記の品目のところに該当するかといったことで個別品目の対応になるということでございます。
次に、右側の収載後、薬価改定時の評価ということでございます。まず、薬価への加算という意味では希少疾病用医薬品の開発、小児用の医薬品の開発、世界に先駆けた日本での開発、それから市販後の真の臨床的有用性の検証といったところで加算が可能といったような状況になってございます。
一方、新薬創出等加算の適用という意味では、オーファンドラッグの場合、それから市販後の真の臨床的有用性の検証の場合に限るといったこと。
それから右上のですね、4つほどバツが付いている所でございますけれども、新薬収載時であれば有用性加算の対象となるような、そういった品目要件を満たすものにつきましては、この点については薬価改定時の加算も新薬創出等加算の適用もないといったような状況でございます。
40コマ目でございます。薬価改定時の加算ということで3つほど、「小児」と「希少疾病」と「真の臨床的有用性の検証」がありますけれども、各年度ごとの該当品目数を記載してございます。真の臨床的有用性の検証については過去5回の改定で3品目しかないという状況でございます。
41コマ目と42コマ目は新規収載時、または効能追加時の加算に関する説明でございます。
それで、43コマ目をご覧ください。こちらは、市販後に真の臨床的有用性が検証された既収載品に関する加算ということで、薬価算定組織から意見が提示されていたものでございます。
「現状」の欄の2つ目のポツをご覧いただければと思いますけれども、現行のルールではですね、小児効能、希少疾病の効能、それから真の臨床的有用性の検証、いずれかの加算がですね、複数該当するといったような場合には、補正加算率の最も大きなものを適用する、いわゆる「併算定不可」というルールになってございます。
これにつきまして、薬価算定組織の意見にございますとおり、薬価算定組織からはですね、品目の市場性を鑑みた小児効能や希少疾病の効能追加にかかる評価と、真の臨床的有用性の評価というのは趣旨が異なるので併算定を可能としてはどうか、という提案がされているところでございます。
44コマ目は、真の臨床的有用性の過去の事例でございます。それで45コマ目、最後でございますけれども、
「論点」といたしましては、既収載品について新規収載時であれば有用性加算が適用され得るような高い臨床上の有用性を有する効能追加等が行われた場合の評価の是非についてどのように考えるか、ということでございます。
説明は以上でございます。
質疑(前半)── スケジュール、配合剤、再生医療等製品
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
はい、ありがとうございました。では、ただいまの説明を踏まえて、論点ごとに3つに分けて協議を行いたいと思います。
では、まず「薬-1」の次期薬価制度改革の検討スケジュール案、それから「薬-2」の3から5ページの配合剤について。
それから、7ページから22ページの再生医療等製品の価格算定について。まずはこの3つについて、ご質問あるいはご意見等ありましたら、お願いしたいと思います。いかがでしょうか。はい、松本委員、お願いします。
.
〇松本吉郎委員(日本医師会常任理事)
では、「薬-2」の論点に沿ってということで、まず4ページ目の「論点」でございますけれども。
3ページ目に、想定しているケースとして記載があるように、成分Aと成分Bについて、単剤として薬価収載されていなくても、成分Aと成分Bの配合剤Dが薬価収載されている場合には、当該配合剤を用いて、新医療用配合剤の特例による算定でよいのではないかなというふうに思いますが。
すなわち、比較薬の合計の0.8とか、ということになろうかと思いますけれども、ただ、単剤に比べると、製造、それから流通経費等の節減が合理化によって見られると思います。合理化ができると思いますので、0.8でなくても、0.7であってもいいのかな(苦笑)、という感じは思いますけれども。
それから、14ページ目の「論点」でございますけれども。
再生医療等製品は、自家細胞由来か他家細胞由来かなどの違いによって、貯蔵や流通における必要なコストが大幅に異なる可能性があります。
現行ルールでは、流通経費については、製品によらず一定の係数を用いて算定していますけれども、個々の製品の特性を踏まえた上で、1製品当たりの流通管理に実際に必要な額を精査することとして、係数を用いた額よりも低くて済むと考えられる場合には、その額を用いるようにすべきと考えます。
一方で、再生医療等製品の製造に当たっては、大量生産が難しくて、品質管理のために頻回の検査が必要など、製品特性をきめ細かく原価に反映させようとすると、非常に高額になる可能性もあると思いますが、これまでの4製品の特性は、かなりばらついていますので、今回、再生医療等製品に特化した新たな算定ルールを検討するには、残念ながら、まだ知見の集積が足りないというふうに考えます。
「論点」の19ページ目でございますが。
価格算定における補正加算額が大きくても、再生医療等製品は通常の医薬品と異なり、1回の投与で済むものもあります。従って、単なる補正加算前の価格の多寡で議論するのがよいかどうかは慎重な検討が必要であると考えます。
そうは言いましても、今後、さらに高額な再生医療等製品が出てきた場合に、現行ルールのままでよいかというと、それもどうなのかなというふうにも思いますので、例えば、市場規模予測が一定額を超える再生医療等製品であっても、原価計算における開示度が50%未満のものなど、品目を限定した上で補正加算前の価格が著しく高いものの加算額について何らかの対応を検討してもよいというふうに考えます。
とりあえず、以上です。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
ほか、いかがでしょうか。では、今村委員、お願いします。じゃあ、松本委員、お願いします。
.
〇松本吉郎委員(日本医師会常任理事)
すみません。21ページ目まで入りましたね。
21ページ目の「論点」ですけれども、条件・期限付承認を受けた品目が改めて承認を受ける際には、あくまで既存治療に対する有用性などが客観的に示されていることが大前提となりますけれども、その場合には、薬価上、何らかの評価を行うことは差し支えないと考えます。
その一方で、医療機器のチャレンジ申請でも議論がありましたけども、既存の治療(薬)と比較して有用性・安全性が逆に示されなかった場合の対応についても検討する必要があるのではないでしょうか。
また、条件・期限付承認期間中の薬価の呼称を「暫定薬価」などとすることについては、あくまで告示などにおける薬価基準などの正式な呼称は変更しないようにして、名称の違いによって医療現場に混乱を生じさせないことを前提とした上で運用すべきというふうに考えます。以上です。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
では、お願いします。
.
〇今村聡委員(日本医師会副会長)
はい、ありがとうございます。今、松本委員のほうからも、ちょっとお話あった14ページの再生医療等製品に関わる貯蔵、流通のことに関して、ちょっと、もうちょっと広めのご質問をしたいと思ってるんですけど。
前回の改定の時にも、この流通経費、原価計算方式における流通経費について、事務局にご質問してご回答いただいたんですけれども、あの時も十分に理解できたというか、納得できたという感じが、ちょっとなかったんで、改めて伺いたいと思うんですけども。
これ、基本的には卸さんの利益率を係数にして掛けるっていうことをするっていうのは一般にやっているけれども、再生医療等製品については、さまざまに貯蔵の方法も流通の方法も、いろいろ手間もかかるからということで、別の体系をと。
まだまだ、なかなか根拠がないので、松本委員の言われたように、今の時点で新たな体系をつくるのは難しいと思うんですけれども、9ページにありますように、非常に手間のかかると思われるようなキムリアにおいてはですね、自己申告で2.4%の係数でいいですよ、ということをおっしゃってると。
つまり、極端に率を下げてもいいというのは、絶対額としては、それなりにもともとが大きいので、金額が大きいからいいんだっていう考え方もあるんだと思いますけど、そうだとすると、要するに必要な絶対額は分かっているということが前提になるというふうに思うと。
そうすると、ほかの製品については、みんな係数を7.5なら7.5%掛けますという、なかなか「正確性・妥当性」という意味でですね、納得しづらい部分があるなあというふうに思います。
もともと、この流通経費に卸の利益率を掛けるということの意味も、ちょっと今、十分に納得できたというふうにも思いませんし、最終的には、さまざまな加算は、こういった経費まで含めた部分に対して加算率を掛けていくということになるので、
当然のことながら、メーカーさんがお願いをして卸さんに搬送していただいてる、あるいは貯蔵していただくという手間がかかるから、その分のコストを計算に入れるっていうことは理解できないわけではないんですけども、その金額によって、相当、薬価そのものに大きな影響が出てくるわけですから、このへんの「正確性・妥当性」というものを、もう少しですね、きちんと詰めていただきたいなという思いがあるので、改めて申し上げました。以上です。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
これはご意見で。
.
〇今村聡委員(日本医師会副会長)
現時点で、何かお考えがあれば。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
では、何かご説明のほう、お願いいたします。
.
〇厚労省保険局医療課・田宮憲一薬剤管理官
はい、ありがとうございます。いま、今村委員からご指摘の点でございますけれども、原価に流通経費を含めていることの意味も含めてということで申し上げますと、基本的に医薬品については、医薬品等につきましては、メーカーで製造されて、卸を通じて流通して、医療機関や薬局に納入されたあとに患者に使用されたり、あるいは調剤されて患者に渡されるという形になります。
従いまして、薬価というのは最終的に患者に届く段階での償還価格ということになりますので、そこに至るまでの流通にかかる経費等も薬価の中に含めているという考え方でございます。
それで、一般的には、いろんなさまざまな医薬品が医薬品卸を通じて流通している中で、ということになるので、通常の原価計算では、流通経費としては医薬品卸の売上総利益率の平均を係数として、参照可能な統計で得たということで、それを係数として用いているということではございますけれども、
今般、問題提起というか論点としても挙げさせていただきましたのは、再生医療等製品についてはですね、特に自家の製品などにつきましては、広く一般に流通させるというような形ではなくて、特定の患者さん、医療機関から取り出して、また特定の医療機関に戻すといったような形になりますので、そういったところの個々のコストのところは、必ずしも今までの考え方と違うところもあるのではないかと。そういったことも含めて、今回、論点として挙げさせていただいているということでございます。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
はい、今村委員、お願いします。
.
〇今村聡委員(日本医師会副会長)
前回もそういうふうに伺っていて、ある程度、薬価にそういうものが入るということ、そのものは理解できるんですけども、売上総利益率でいいのかどうかであるとか、あるいは今、お話しになったように、例えば貯蔵、保存に手間がかかるんだから、再生医療等製品については、その部分が増えるっていう話なのか、あるいは非常に数が少なくて、そんなに大量に貯蔵、保存しなくてもいいのだから、コストは下げられるのかって、そのへんのお考えがちょっと分からなくてですね。
で、キムリアについては、非常にその、企業の自己申告によって、うんと低いパーセンテージでもいいですよっていうことを、どう考えるかと。これ、事前にこの数字が出てきたときに、事務局としては、その根拠みたいなものは、当然、確認はされてるんだと思うんですね。
そうだとすると、絶対的に、どれぐらいのコストがかかるかっていうことは、ある程度、分かるっていうことが前提なのかなあというふうに思うんですけど、そのへんはいかがなんですか。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
では、薬剤管理官、お願いします。
.
〇厚労省保険局医療課・田宮憲一薬剤管理官
キムリアのように、自家製品の場合ですと、まさに流通の形態が違って、医療機関との間で、出荷判定してから医療機関に納入するまでといったところのコストということになるので、比較的、どの程度コストがかかるのかといったところについてですね、分かりやすいところはあろうかなというふうには思っているところでございます。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
では、吉森委員、お願いします。
.
〇吉森俊和委員(全国健康保険協会理事)
ありがとうございます。同じ14ページなんですけれども、今、松本委員、今村委員がおっしゃったとおりなんです、と私も思ってるわけです。
当面の、この再生医療等製品への対応については、現状、まだ4品目ですし、今後、待ったなしでいろいろ開発されてるというのも状況判断しますと、従来のこの方法をいつまで続けるんだというところ、個別で対応せざるを得ない。
今の薬剤管理官の説明を聞きましても、個別で見ていく。自家の場合は分かりやすく、じゃあ、他家製品だとどうするというようなところも、当然ながら出てくるわけでございますし。
生産方式、流通、貯蔵についての従来の低分子が主流で大量生産、スケールメリットを標榜した一般的な医薬品、これにおいては、やっぱり設備、システム等のコストパフォーマンスは今回の再生医療等製品とは違うわけでございますから、現状、価格算定においての在り方については、従来の薬価算定方式の当てはめでは、合理的妥当性は、やはり担保できないということは、皆さん、もう明白に分かってるわけで。
当面は、個別で対症療法的に議論しながら進めるとしても、今後どうするんだというところは、ここでやはり議論しておかないといけないんだろうというふうに思います。
そういう意味では、この再生医療等製品の評価の妥当性・合理性を追求して、これらの製品の価格算定については、独自の体系をつくるということが必要だと考えておりますし、当然、そうであるならば、事務局および薬価算定組織において、この再生医療等製品に関する治験を集積していくわけで、まだ4品目ですし。
今後、それぞれ、やはり集積をしていくということで、その製造工程、流通コストの構造分析、そういうことのエビデンス集積、検証、これを進めないといけない。
そういう意味では、当然、この組織対応が必要だというふうに思いますし、そういう対応をするにも、時間的な、時間軸からいえば、相当時間がかかる。そういうことであるならば、どういうふうにしたらいいのか、どういう組織で何をどうするのかということは、やはりワーキングチーム的なものをつくって、早急に専門組織、厚労省、中医協を含めて、具体的対応の議論をスタートすることが、まずは先決じゃないかというふうに思います。
そのためには、先例として、費用対効果評価制度をつくり上げたときのように、対応方針を明確にして、期限を明確にした行程表等をつくり、検討を進めるという手順がよろしいんじゃないかというふうに思いますので、業界団体のヒアリングも含めて、また実際の製造現場、貯蔵方法がどうなのか、流通方法がどうなのか、そういう現場実感も踏まえて議論を進める必要があるんじゃないかというふうに思います。以上、意見です。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
どうもありがとうございました。ほかはいかがでしょうか。はい。では有澤委員、お願いいたします。
.
〇有澤賢二委員(日本薬剤師会常務理事)
はい、ありがとうございます。今の議論と同等なんですが、やはり再生医療等製品は一般の医薬品と違って、やはり流通形態というのが全く違ってくると思います。例えばキムリアについても、書いてあるように、窒素で封入して、しかも生産拠点であるアメリカですかね。あちらのほうに輸送して、さらに戻してくる。そういった中で、2.4%っていうふうな形で自主申告されてます。
一方で、ほかのステミラックなんかも同等に自己由来の細胞ですけども、7.4%という形で一律に付けていますので、この流通経費については、やはり特に再生医療等の製品に関してはですね、実態を踏まえて、今後、しっかり検証して精査していく必要があると考えます。以上です。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
ほかはよろしいでしょうか。
はい、では、2番目の24ページから35ページの新薬創出等加算……。何かありますか。すいません、幸野委員、すいません。失礼しました。では、幸野委員、お願いします。
.
〇幸野庄司委員(健康保険組合連合会理事)
大丈夫。あとで。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
では、その次の新薬創出等加算対象品目を比較薬とする場合の薬価算定について、ご質問、ご意見……。
.
〇平野秀之専門委員(第一三共株式会社執行役員渉外部長)
部会長、すみません、専門委員から。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
あ、どうもすみません。どうぞお願いします。
.
〇平野秀之専門委員(第一三共株式会社執行役員渉外部長)
すみません。ありがとうございます。再生医療等製品の一連の「論点」につきまして、専門委員の立場から一言コメントさせていただきます。少し長くなりますことをお許しいただきたいと思います。
まず、資料14ページの再生医療等製品の価格算定について、先ほど、各号側の委員から、流通経費等につきましては、ご議論ございましたが、この再生医療等製品につきましては、製品の特性上、流通に当たっては非常に手間がかかったり、設備、システムが必要になるということがございます。こういうことを鑑み、製品ごとに流通経費の算出が異なるということを、まずご理解いただきたいということでございます。
また、独自の算定の体系をつくることにつきましては、再生医療等製品は、その製造工程が従来の医薬品と異なることは、もう周知のことでございますが、1回の投与で治療が完結するという場合があるなど、その特殊性を考慮すると、既存の医薬品の算定方式だけでは、適切な価格設定が難しい場合もございまして、今後、独自の算定の体系を構築する必要があると考えます。
これは先ほど、吉森委員のほうからも、この意見に対してのご発言があった次第でございます。
現時点では、収載された製品が4品目のみであるということを踏まえ、今後、事例を集積しつつ、検討を進めていただきたいと思います。
資料19ページの単価の高い再生医療等製品の補正加算につきまして、でございます。これにつきましては、先般の意見陳述でも申し上げましたけども、再生医療等製品は1回の投与で治療を完結する場合があることなどを踏まえて、単に単価が高いことに着目して、補正加算率に傾斜を設けることは妥当ではないと考えております。
最後でございますが、資料21ページの論点、条件・期限付承認を受けた再生医療等製品についての「論点」でございますが、条件・期限付承認制度の特性上、改めて承認を受ける際には、初回承認時には明らかでなかった医療上の有用性が示されることは十分あり得るので、改めて、承認を受ける際には有用性評価を行うような仕組みが必要であると考えております。
最後でございますが、改めて承認を受けるまでの期間の価格の呼称につきましては、実態を分かりやすく盛り込む見地から、「条件・期限付承認時価格」といった呼称をご提案いたします。以上でございました。ありがとうございました。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
大変失礼しました。では、幸野委員、お願いします。
.
〇幸野庄司委員(健康保険組合連合会理事)
今、専門委員からの意見がありましたので、ちょっとここについては反論させていただきたいと思います。
単価の高い再生医療等製品の補正加算なんですが、これは前回の薬価制度改革によって、補正加算が従来は営業利益率に付いていたので、比較的、範囲が狭まったんですが、薬価全体に付くということに前回変更になりましたので、かなり大きな影響になってきた。
われわれ、これ、営業利益率から全体に付けるということについては反対したんですが、まあ、こうなってしまったんですが。
その結果、どういうことになってるかというと、全体にこう、付くようになったんで、企業の総原価の開示度がですね、低くても、その影響が薄くなってきたという弊害が出てきてて、この企業の開示度のインセンティブに、あまりならなくなってきたということがあって、これが非常に問題でありますので、やはり高額なものについては、企業の開示度のインセンティブという面からも、やはり傾斜配分は検討すべきだと思います。
で、市場規模や開示度に関係なく、やはり一定額以上の単価の高い医薬品については、傾斜配分を行っていくべきというふうに強く思います。以上です。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
では、平川委員、お願いします。
.
〇平川則男委員(日本労働組合総連合会総合政策局長)
質問なんですけど、13枚目のスライドで、コストの特徴というのが記載をされておりますけれども、
いずれも定性的で、当然、4品目しかないということで、限られるのかもしれませんけども、具体的に、今後議論するに当たって、この定性的な内容をもとに議論するというのは、なかなか厳しいなというふうに思ってますけども、このへん、事務局としてどう考えてるのかをお聞きしたいというのが1つと。
原価計算も、普通の一般薬と違って、この再生医療等製品については、この原価計算の方式が、場合によっては、より分かりやすくなる可能性もあるのかどうなのかということも、ちょっとお聞きをしたいと思います。この2点、質問したいと思います。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
これは事務局のほうでよろしいですね、2つとも。はい、では薬剤管理官、お願いします。
.
〇厚労省保険局医療課・田宮憲一薬剤管理官
ご指摘ありがとうございます。13コマ目にあるコストの特徴に関して、なかなか定性的ではないかというご指摘でございます。
実際の製品というのは4品目に限られるということもございますし、また、個々の製品ごとにですね、いろいろと企業ノウハウなどもあろうかと思いますので、ちょっとまあ、そこは業界団体、あるいは個別の企業などとも相談させていただきながら、どのような、もう少し議論に資するような細かい資料が出せるのかも含めて検討させていただければと思います。
それから、あと原価計算方式によって、これまでよりも分かりやすくなるのかどうかといったところにつきましては、それはなかなか一概にはお答えしにくいかなというふうに思っております。
やはり、実際の製造コストのところ、製造過程のところというのはですね、かなり企業の機密性が高いところもございますので、そういった中で、どの程度開示されるかとかですね、そういったところも含めての薬価算定組織での議論になろうかなというふうには思います。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
では、ほかはよろしいでしょうか。最初の3つの点。では、ありがとうございました。
質疑(後半1)── 新薬創出等加算対象品目を比較薬とする場合の薬価算定
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
では、次に24ページから35ページの新薬創出等加算対象品目を比較薬とする場合の薬価算定について、ご質問、あるいはご意見等ありましたらよろしくお願いいたします。では松本委員、お願いします。
.
〇松本吉郎委員(日本医師会常任理事)
35ページ目の「論点」ですけれども、類似薬効比較方式(Ⅰ)によって、比較薬と1日薬価を合わせて算定することは、市場での公正な競争を確保するという意味でも、これまで積み上げてきた薬価算定ルールの基本となる考え方であると理解しております。
一方で、比較薬が新薬創出等加算の対象品目である場合に、当該比較薬については、新薬創出等加算の要件から外れた際に、累積加算額を一気に差し引いて改定することになることから、それとのバランスで言いますと、新薬創出等加算対象品目を比較薬として、類似薬効比較方式(Ⅰ)で算定された品目についても、いずれかのタイミングで比較薬の累積加算額相当分を差し引くのが自然だとも思います。
従って、新薬創出等加算対象品目を比較薬として、類似薬効比較方式(Ⅰ)で算定された品目についてですが、収載時にですね、累積加算相当額を差し引くのがよいかは議論があるところでありますけれども、少なくとも、収載後、一定期間が経過するまでの間に新薬創出等加算の対象となる効能や小児効能など、医療上必要な効能が追加されない限りは、累積加算額相当分を差し引くのが妥当であるというふうに考えます。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
ほかはいかがでしょうか。では、吉森委員、お願いします。
.
〇吉森俊和委員(全国健康保険協会理事)
はい、ありがとうございます。松本委員と同様で、35ページですけれども。
基本的には、やはり新薬創出等加算の対象外である以上、比較薬の新薬創出等加算の累積加算額を控除して薬価算定を行うことは、当然、自然だというふうに考えております。
従って、類似薬効比較方式(Ⅱ)で算定した医薬品について、企業側が前回、主張されておりましたけれども、控除額に一定の上限、措置を設けるというような必然性はないと考えておりますし、また、類似薬効比較方式(Ⅰ)で算定した医薬品についても、基本的には同様の取扱いをする方向で検討していくべきだというふうに考えます。
一方で、資料等で提示されておりますけれども、価格差の拡大が課題である。その差がますます大きくなって、見直さなければならない状況だというのであればですね、それはこの算定方式が仕組みとして限界なんじゃないか。
この仕組みについて、対症療法的に対応していくんではなくて、算定方式の考え方を根本から見直す必要があるんじゃないかというふうにも考えます。
この対症療法的にいろんなことを繰り返してるうちに、あまりにもこの制度が複雑化し、逆に妥当性、合理性を欠く結果になってしまうというふうに、そういう懸念がありますので、やはり自然に対応して、本当に課題があるならどうするか。この方式でいいのかっていうのを根本的にやはり見直す方向で検討していくべきだというふうに思います。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
ありがとうございます。じゃあ、幸野委員、お願いします。
.
〇幸野庄司委員(健康保険組合連合会理事)
35ページの論点、私も外すべきだということなんですけど、前回の薬価制度改革で、新薬創出等加算に企業区分が入ったということで、企業区分Ⅰ、Ⅱ、Ⅲによって加算額も違ってくるということで、その差をそのまま比較するということで、もう制度上の矛盾が出てきてると。企業区分Iの加算と企業区分Ⅱの加算は、当然違うわけで、それを同じように新薬創出等加算に比較するというのは、これはおかしい。
理屈上、全くおかしい話で、こういった制度の矛盾が出てきてるので、これはもう、企業要件も入ってる新薬創出等加算分は除外して算定すべきというのが、理屈としては正しいかと思います。
それで、今後、どういう議論をしていくかというところなんですけど、次の「論点」にあります効能追加等による革新性・有用性の評価という議論と、この新薬創出等加算を外すかどうかというのはセットでこれ、考えていく必要があるんじゃないかというふうに思います。
といいますのも、現行制度においても、既収載品について、小児適用、希少疾病、真の臨床的有用性に係る加算というのがあって、これは収載後も加算が付けられるわけで、小児以外は、これを取ると新薬創出等加算の対象になるというルールがあるわけですね。
で、今回、提示されてるのは、有用性についても、収載後に認められれば、これは付けてもいいんじゃないかということが、一時、論点として掲げられてて、この部分が新薬創出等加算を収載時にどうするかというのと大きく関連すると思うんですね。
もし、ポテンシャルの高い収載薬が出たとしたら、それが収載時は新薬創出等加算を除外して付けても、もし有用性加算を、その後、効用追加で取れば、そのときに新薬創出等加算の対象になるわけですから、ポテンシャルの高い医薬品であれば、収載時に新薬創出等加算分を除外して付けても、あとで評価されるということになるわけで、
この議論がどうなるかはちょっと分からないんですが、もしそういうふうな方向になれば、新規収載時に新薬創出等加算分を外しても、あとで評価されるということになりますので、
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
ありがとうございます。ほかはいかがでしょうか。はい、上出委員、お願いします。
.
〇上出厚志専門委員(アステラス製薬上席執行役員渉外部長)
ありがとうございます。今、いろいろご議論、ございましたけれども、この類似薬効比較方式(Ⅰ)と(Ⅱ)の違いにつきましては、本日の資料でも整理いただいてるところでございますが、患者さんの状態に合わせて適切な薬剤選択を行うためには、当該新薬の中で一定程度の選択肢は必要であるというような考え方から、3番手の品目までは類似薬効Iというふうにされているものというふうに理解をしております。
また、類似薬効比較方式の基本的な考え方は、当該新薬の薬価を効能・効果や薬理作用が類似している既存薬の1日薬価に合わせるというのが基本ということでございますので、これらの点を考えれば、類似薬効比較方式(Ⅰ)で算定される新薬の薬価は、既存薬のその時点での薬価、1日薬価に合わせるのが自然ではないかというふうに考えているところでございます。
また、先ほど幸野委員から効追(効能追加)の評価といったことについてコメントございましたけれども、ご指摘のように、今日の資料でもございましたが、この類似薬効比較方式(Ⅰ)で算定されました新薬の4割程度は効追をしているという事実がございます。
こういった新薬が、仮にですね、収載時に既存薬よりもですね、低い薬価で算定されますと、そういった効追のインセンティブといった面でも影響が出る可能性もございますし、そもそも2番手、3番手の開発といったことにも影響がある可能性もございます。
そういったことも含めましてですね、この類似薬効比較方式(Ⅰ)で算定されます新薬の薬価算定に当たりましては、加算は控除すべきではないのではないかというふうに考える次第でございます。以上でございます。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
ほかはよろしいでしょうか。では、吉森委員、お願いします。
.
〇吉森俊和委員(全国健康保険協会理事)
効能追加について、ちょっと話が出ましたので。この効能追加にとって方向性、この「論点」の方向性というのは理解するものでありますけれども。
やはり、この臨床上、有用な新規の作用機序とか、既存治療と比べて高い有用性・安全性が客観的に示されるとか、この品目の有用性に着目した真の臨床的有用性、これに関わる加算は合わせて算定するという、理解はいたしますけれども、
じゃあ、この算定した加算の評価基準、仕組み、これについては先ほども意見ありますけれども、新薬創出等加算の品目等々の要件設定等々も踏まえてですね、きちんと合理性・公平性・透明性を担保できるような補正加算、新薬収載時の補正加算と同等の評価ということではなくて、きちんとあとで併算定する場合にどうするのかという仕組みを、やはり考えていかないといけないんじゃないかというふうに思いますので、ここについて議論すべきだというふうに思います。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
質疑(後半2)── イノベーションの評価
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
では、この効能追加を含めた37ページから45ページのイノベーションの評価のほうについて、ご質問等、あるいはご意見等いただければと思います。では、松本委員、お願いします。
.
〇松本吉郎委員(日本医師会常任理事)
45ページ目の論点ですが、確かに新規収載時に比べて、収載後の革新性・有用性の評価は限定的にはなっていますけども、通常、効能追加によって市場拡大することを考えますと、新規収載時と全く同じ基準で評価するのは適当ではないというふうに思います。
市販後の効能追加の評価に当たっては、新規作用機序による既存治療に対する有用性が客観的に示されている場合に限定するなど、慎重な検討が必要であると考えます。
また、開発に関するインセンティブと考えられる小児効能や希少疾病に係る効能追加に関する評価と、医薬品の臨床上の有用性に基づいた真の臨床的有用性の評価については、その趣旨は異なることから、併算定を認めても差し支えないのではないかというふうに思います。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
ほかはいかが……。では、今村委員、お願いします。
.
〇今村聡委員(日本医師会副会長)
はい、ありがとうございます。ちょっと細かい点で事務局にご質問したいと思うんですけども、42ページに薬価改定時の加算ということで、3つ目の(3)で「市販後に真の臨床的有用性が検証された既収載品」という項目がございますけれども、
意味的には、これ、たぶん「新たな臨床的な有用性」というような意味なんだと思うんですけど、この「真の」って言ってるものの何か客観的な基準があるのかどうか。どうであれば「真の有用性」なのかっていうような、そういうお考えがあるのかどうか。
で、それに伴って、黒いポチが2つありますけれども、1つ目が「国際的に信頼できる学術雑誌への論文の掲載等を通じて公表されたもの」と。これはこれでいいんですけど、
2つ目なんですけど、「ただし、その根拠となる調査成績が大学等の研究機関により得られたものである場合など」っていう文章なんですけど、最後に「除く」って書いてあるので、この意味は、「大学研究機関のものじゃなきゃ駄目です」っていうことを言ってるのか、「大学研究機関などを除く」って言ってるのか、ちょっとこれ、意味的によく分からないんですよ。これのちょっと説明を、ぜひ事務局にお願いしたい。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
では、2点、質問ありました。薬剤管理官、お願いします。
.
〇厚労省保険局医療課・田宮憲一薬剤管理官
ご質問の件でございますけれども、ここで薬価算定ルールにおける真の臨床的有用性という考え方でございますけれども、基本的な考え方としては、既に薬事承認を受けている効能・効果に対して、上市後に市販後臨床試験を行って、承認時に確認されていなかった、より直接的な臨床的有用性が確認されたものに対して加算を行うという考え方でございます。
具体的にはですね、既存の事例が分かりやすいかと思うんですけども、44コマ目にですね、ジャディアンス錠というものがございますけれども、この例でご説明しますと、これは血糖値の指標であるヘモグロビンA1cの値の推移等で有効性が薬事承認時には評価され、2型糖尿病の効能で承認されたものでございますけれども、
一般に糖尿病につきましては、全身の動脈硬化症が促進されて、それが心筋梗塞ですとか脳梗塞等の原因となることが知られておりますので、プラセボを対照とした市販後の臨床試験においてですね、これらの心血管系のイベント、心筋梗塞とかですね、そういったイベントを統計学的に発症リスクの低減が認められたという点について、今回のこの規定に改定するという形で評価しているというものでございます。
従いまして、真の臨床的有用性というのは、承認時に例えば効果の検証に時間がかかるとかいうことで、代替の指標で評価されたものではなくて、最終的に治療目標での有用性というか、直接的な臨床的有用性をイメージしたものというふうにご理解いただければと思います。
それから、42コマ目の(3)の2つ目のポツの趣旨でございますけれども、今申し上げたように、市販後に大規模な臨床試験などをしっかりと製造販売業者が行ってエビデンスを出したということに対する評価ということなので、仮にその企業と直接関係のない大学などの研究機関がですね、自ら自主的に研究費などを用いて、大規模なスタディをやったというような場合ですと、その企業がなんか、まあ、言ってみれば……、エビデンスを出すために努力したということではないので、そういうものは評価の対象とはなりませんという趣旨で書いてあるものでございます。
.
〇今村聡委員(日本医師会副会長)
ありがとうございました。2つ目については、よく分かりました。
1点目も、実際の例を今、お示しいただいたんで、薬事承認を得た時の有用性とは、また別の新たな、という意味では、非常によく分かったんですけれども、
いわゆる客観的な基準みたいなものですね。今、心筋梗塞、糖尿病のお薬であったんだけども、心筋梗塞の発症を減らしましたというのは非常に分かりやすい例なんだけど、そういう何か客観的な、こういうものであったらそれを認めますみたいなものがあるのかどうか。
それは新たにどこかで議論をして、これだったら、薬事承認の時よりも、さらに新たな薬効があるんだねっていうような議論の下に決まることなのか、そのへんだけ、ちょっと。基準があるのかどうかだけ教えていただければ。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
はい、薬剤管理官、お願いします。
.
〇厚労省保険局医療課・田宮憲一薬剤管理官
はい。今、私が説明した基本的な考え方に基づいた上でですね、品目はいろいろ、多種多様でございますので、個別の企業から申請、薬価改定時にデータの提出などがあった際にですね、薬価算定組織の中で医学、薬学の専門家の中で議論をしてですね、それに値、加算に値するかということをご議論いただいているというような形です。
.
〇今村聡委員(日本医師会副会長)
はい、分かりました。ありがとうございました。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
ほかはいかがでしょうか。では、幸野委員、お願いします。
.
〇幸野庄司委員(健康保険組合連合会理事)
45ページの論点なんですけど。
先ほど言いましたとおり、もし、こういった既収載品について、再度、評価するんであれば、これはやはり収載時に比較薬が新薬創出等加算を受けたものである場合は、それを除いて収載されるということが最低限の条件になるというふうに思います。
というのも、これら既収載品について再評価するのであれば、それは収載時に、もう類似薬が新薬創出等加算分を含めて、この薬価が決まってるんであれば、ある程度、この有用性については、その時点で評価されてるわけであって、評価されてるものをさらに、再度、効能追加等によって評価するということは、やはり、これ、より高く評価することになるんで、
こういうことを入れるんであれば、最低限、収載時に比較薬が新薬創出等加算の対象になってるものについては、それを除外するということが最低限の条件になるというふうに思います。
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
はい。ほかはいかがでしょうか。はい、では有澤委員、お願いします。
.
〇有澤賢二委員(日本薬剤師会常務理事)
ありがとうございます。45コマ目の論点でありますけれども、
やはり、小児効能の追加とか、希少疾病に係る効能追加、さらに真の臨床的有用性の検証、それぞれの加算、いずれも複数になるものは補正加算率の併算定ができないというふうになっておりますので、開発インセンティブ、あるいはモノの有用性、さらに治療の質の向上ということから考えればですね、十分にこれは併算定を可能としていいと思います。
ただし、ただしですね、いたずらに、その適用が広がるということではなくて、しっかりとそのルールとか、その方法については、しっかり、基につくった上で進めていただければと思います。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
ありがとうございます。ほかはいかがでしょう。では、宮近委員、お願いします。
.
〇宮近清文委員(経団連社会保障委員会医療・介護改革部会部会長代理)
はい。効能追加等に関する革新性・有用性の評価に関する質問ですけれども、イノベーションを適正に評価していくということは、薬価制度を考える上で非常に重要だと思うんですけれども、そこで39ページの資料で、現在の薬価制度におけるイノベーション評価の俯瞰図という一覧表が示されております。
その39ページの表で、丸バツ表示があるんですけれども、縦列の右から2番目の収載後の薬価改定時の薬価への加算という項目で、希少疾病、それから小児用の医薬品の開発、世界に先駆けた日本での開発という内容については丸が付いてるんですけれども、
その一方で、有用性、新規作用機序医薬品についてはバツというふうになってるわけですけれども、現在の薬価制度において、こうした区別になっているというのは、その背景といいますか、過去の経緯というようなものがありましたら教えていただきたいんですけれども。以上、質問です。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
はい。では薬剤管理官、お願いします。
.
〇厚労省保険局医療課・田宮憲一薬剤管理官
宮近委員のご質問でございますけれども、過去の経緯から申しますと、新薬のイノベーションの評価というところは、基本的には新規収載時に有用性加算とかですね、画期性加算とか、そういった形の加算で評価するというのが基本的な考え方、当初の考え方だったと思っております。
それが途中から、例えば、その後にオーファンの開発や小児用の医薬品の開発、世界に先駆けた日本での開発、それから市販後の真の臨床的有用性の検証がなされたような場合については評価を、薬価改定時に収載後に評価してもいいのではないかという議論が中医協の中でもありまして、そこについて、現時点では加算が可能な状況になっているという状況でございます。
その結果、丸になっている所は、そういう形で評価をすることになっておりますけれども、一番最初の有用性の高い医薬品の開発とか、そういったところについては、これまでは検討されてきていないという、そういう状況でございます。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
宮近委員、よろしいでしょうか。ほかはいかがでしょうか。はい、では上出委員、お願いします。
.
〇上出厚志専門委員(アステラス製薬上席執行役員渉外部長)
はい、ありがとうございます。効追(効能追加)時の評価ということにつきまして、いろいろご議論ございましたけれども、この件につきましては、先般の業界の意見ヒアリングの中でも、こういったものを評価していただきたいというところを申し上げたところでございます。
その趣旨は、これはもう既に議論されたところでございますけれども、現行の薬価制度では、仮に新規収載時であれば有用性加算が適用されるような効追を行った場合であっても、現在はそれは評価されないという現状があるというところでございます。
この新規収載時の加算の評価、これはもう、ご存じのとおり、その薬剤が臨床上有用な新規の作用機序を有しているか、もしくは類似薬または既存治療薬に対して高い有用性、もしくは安全性を有することが客観的に示されているかどうか。また、その当該新薬の対象となる疾患、または負傷の治療方法の改善といったものが客観的に示されているかと。
こういったことを厳しく評価して、加算の評価がされるということでございますので、仮に効追の適用でですね、こういった既存の治療に対して、明らかにこういったことが証明されなければ、それは加算の対象にはなり得ないというところでございますので、そのへんのところもですね、含めて、ぜひ今後も議論をいただきたいというふうに考えております。
また、先ほど、真の臨床的有用性につきましても、ご議論ございました。現時点では3品目がその対象になってるということでございますが、それ以外の場合にもですね、薬価収載時には十分なエビデンスが得られていなかったために、有用性の評価を受けていない。
そういった品目が、市販後にですね、ランダム比較試験ですとか、リアルワールドデータ等のエビデンス、こういったものの集積によって、既存治療に対する高い有効性・安全性が客観的に示されるという場合もございますので、そういったものも含めて、ぜひ評価をいただきたいというふうに考えております。以上でございます。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
では、幸野委員、お願いします。
.
〇幸野庄司委員(健康保険組合連合会理事)
専門委員にちょっとお伺いしたいんですけど、収載時に比較薬が新薬創出等加算になってる場合、それを含まれて収載されるんで、ある程度、比較薬の有用性も含まれて薬価が決まってるということになるので、ある程度、その段階で有用性っていうのは評価されてるというふうに考えてるんですけど、それは違いますか?
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
では上出委員、お願いします。
.
〇上出厚志専門委員(アステラス製薬上席執行役員渉外部長)
おっしゃるとおりだと思います。あくまでも比較薬と同等の有用性というものが、そこで評価されたということだと考えております。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
幸野委員、お願いします。
.
〇幸野庄司委員(健康保険組合連合会理事)
で、それで、ある程度、有用性というのは収載時に評価されてて、再度、有用性を評価するっていうのは、ちょっと重複的に評価してるようなイメージなんですけど、それは違いますか。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
上出委員、お願いします。
.
〇上出厚志専門委員(アステラス製薬上席執行役員渉外部長)
おっしゃってるのは効追の評価でございますか。
これは、効追が収載時には、その効能・効果がなかったわけでございますので、今度は、その効追について、改めて既存の治療と比べて、先ほど申し上げましたような項目で、有用性が勝っているか、そういった評価をしていただきたいということでございます。
ですので、収載時は比較薬と同等であったけれど、効追をすることによって、その効追の疾患領域では、革新的な新薬という位置付けになる場合があるのではないか。そういう場合には、評価をいただきたいという意見でございます。
.
〇中村洋部会長(慶應義塾大大学院経営管理研究科教授)
よろしいでしょうか。ほかはいかがでしょうか。
はい、ありがとうございました。では、ほかに質問等ないようでしたら、本件にかかる質疑はこのあたりにしたいと思います。
本日、予定された議題は以上になります。次回の日程につきましては、追って事務局より連絡いたしますので、よろしくお願いいたします。
それでは、本日の薬価専門部会は、これにて閉会といたします。どうもありがとうございました。


.jpg)


















-1-185x130.jpg)






【速記録】_ページ_01-のコピー.jpg)
【速記録】_ページ_01-のコピー.jpg)
【速記録】_ページ_01-のコピー.jpg)
_2023年8月2日の総会-1-190x190.jpg)

_2023年6月21日の中医協総会-190x190.jpg)








_2022年8月3日の中医協総会-190x190.jpg)















-190x190.jpg)


_20190807_中医協材料ヒアリング-300x300.jpg)





























